



元素周期表
历史

德米特里·门捷列夫
较早的系统化元素列表
1789年,安托万·拉瓦锡发布了包括33种化学元素的列表。拉瓦锡将元素归类为气体、金属、非金属和土质, 而化学家在之后的一个世纪里一直寻找更准确的分类方式。1829年,约翰·德贝莱纳观察到许多元素能根据化学特性三个成组,例如锂、钠和钾便能归为软而活性的金属。德贝莱纳也发现,当每组的三个元素按原子量排列时,第二个元素往往大约是第一和第三个元素的平均。 这之后被称为三耦律(Law of Triads)。 德国化学家利奥波德·盖墨林使用这个系统,直到1843年已辨认出三个一组的10组,四个一组的3组,以及五个一组的1组。让-巴蒂斯特·杜马于1857年发表他的成果,描述了不同金属组之间的关系。虽然许多化学家能够找到小组元素之间的关系,但他们仍没有发展出一套能涵盖所有元素的系统。
德国化学家奥古斯特·凯库勒曾于1858年观察到碳通常和其他元素以1比4的比例结合,如拥有1个碳原子和4个氢原子的甲烷。这个概念最后被称为化合价。1864年,德国化学家尤利乌斯·洛塔尔·迈耶尔发表了一张以化合价排列的元素表,包括了49个当时已知的元素。从该表能看出,拥有相似特性的元素一般有相同的化合价。
英国化学家约翰·纽兰兹在1864至1865年间攒写了一连串的论文,描述他自己的一套元素归类方式:当元素根据原子量从轻至重排列后,相似的物理及化学特性以每8个元素的周期重复,他将此比喻为音乐中的八度。 这所谓的“八行周期律”却受到人们的讽刺,而化学学会也拒绝发布他的研究。 不过,纽兰兹能够画出一张元素列表,并以此预测了新的元素,如锗。化学学会要在承认了门捷列夫的成果五年之后才承认纽兰兹的发现的重要性。
门捷列夫的周期表

门捷列夫1869年的周期表。注意表格中周期为列,族为行。
俄罗斯化学教授德米特里·门捷列夫和德国化学家尤利乌斯·洛塔尔·迈耶尔分别在1869和1870年独立发表了他们的周期表。 他们的周期表各式相似:以原子量横向或竖向排列元素,并在元素特性重复时另开一行或一列。 门捷列夫的列表的成功是由于两点:首先他在表中留下空格,对应于还没有发现的元素。 门捷列夫并不是第一位这样做的化学家,但他是第一位通过周期表中的趋势预测未知元素(如镓和锗)的特性的人。 第二,他决定有时不按原子量排序,而与相邻的元素互换,如钴和镍,以此将元素依照化学族分类。随着原子结构理论的发展,人们发现原来门捷列夫的元素是按照原子序排列的。
进一步的发展
门捷列夫创造元素周期表后,化学家不断在自然界中发现新的元素,填补当初的空格。 一般认为最后一个发现的自然元素是钫(门捷列夫称之为eka铯),发现于1939年。 然而,1940年合成的钚在1971年被发现少量地自然产生。
随着有关原子内电子排布的量子力学理论的发展,人们发现周期表中的每一行(周期)对应于填充一个电子壳层。在门捷列夫最初的周期表中,每个周期的长度均等。但是,由于更大的原子拥有更多的电子支壳层,现代的周期表中较下的周期长度较长。
通过制造超铀元素,周期表经过极大的扩充,从1939年合成的镎开始。 由于许多的超铀元素都高度不稳定并很快经历核衰变,因此这些元素在产生后的探测十分困难。最新命名的元素为Nh、Mc、Ts和Og,于2016年11月28日正式获得认可。
元素周期表
本模板:
图解:
碱金属碱土金属镧系元素锕系元素过渡金属主族金属类金属非金属卤素稀有气体 待确认化学特性
在标准状况下,序号 绿色 者为气体;序号 蓝色 者为液体;序号 黑色 者为固体;序号 灰色 者为未知相态。
所有版本的元素周期表都只包含化学元素,而不包含混合物、化合物或亚原子粒子。每个元素的各个同位素都在同一格中表示。在标准周期表中,元素依照其原子序(原子核中质子的数量)顺序排列。当一个电子开始填充新的原子壳层时,周期表另起一行(周期)。元素的某个电子支壳层拥有的电子数决定元素的列(族),如氧和硒在最外的p支壳层均有4个电子。周期表中较低的周期较长,较右的族较长(但最大的碱金属族却是位于最左,而第二大的碱土金属族则在碱金属族右边)。一般来说,化学特性相似的元素在周期表中归在同一族中,但是在f-区和d-区中,某些同周期的元素有着相似的特性。因此,如果知道邻近元素的特性,便能相对轻易地预测到某化学元素的特性。在一些元素周期表里(如化学星空)存在0号元素,这是指原子中仅含中子,不含质子的一种假像元素,但这种用法存有争议。
截至2016年,周期表包含118个经过证实的化学元素,均受国际纯粹与应用化合会(IUPAC)承认并命名。当中98个元素存在于自然界中:84个为原生核素,另有14个元素只出现在原生元素的衰变链里。 从锿到 的所有元素虽然不在宇宙中自然产生,但是由于经过人工合成,现已全被IUPAC承认。 所有锿(原子序99)以后的元素都没有经过在宏观尺度下的观察。 到2013年为止,人们还没有成功合成原子序118之后的任一个元素。
在印刷版或其他正式的周期表中,每个元素格内通常有几项元素的基本特性:原子序、化学符号和名称。其他常见的特性包括:原子量、密度、熔点、沸点、固态晶体结构、来源、电子排布、负电性和最常见的化合价。
根据定义,每个化学元素都有它唯一的原子序,相等于其原子核中质子的数量,而大部分元素的各个原子有不同的中子数,这称作同位素。例如,所有碳原子都有6颗质子,其中大部分有6颗中子,但1%有7颗中子,另外很小一部分(碳-14)更有8颗中子。因此碳有3个自然同位素。周期表中从来不区分同位素,而是把它们归在同一个元素之下。没有稳定同位素的元素在表中标以其最稳定的同位素质量,以括号括住。
排版
在现代的周期表中,元素根据原子序的顺序从左至右排列,并在每个惰性气体后另开一行。新一行的第一个元素一定是碱金属,其原子序比前一个惰性气体大一(例如,惰性气体氪的原子序为36,而新一行始于碱金属铷,原子序为37)。目前表中没有任何空格,因为从氢到Og的所有元素都已被发现。由于元素均以原子序顺序编号,因此在提到一系列元素时,往往会使用“铁至锌”、“铀之后”等字词。“轻”和“重”也会非正式地用于表示元素的相对原子序(而非密度),如“比碳轻”和“比铅重”等,然而元素的质量并不一定随着原子序增加。如52号元素碲的平均重量比53号的碘要高。
氢和氦经常被放置在与它们根据电子排布似乎应在的区块不同的位置。氢通常在锂之上,但有时也会在氟甚至碳之上。 氦则几乎永远在氖之上,因为两者的化学特性十分相似。
直到质子和中子被发现和了解了之前,周期表中元素根据原子序排列这一规则并没有重要性。门捷列夫的周期表采用的排列方式是根据原子量,因为原子量的测量在当时已有一定的准确性。在绝大多数情况下,这一规则能对元素特性给出比当时所有其他理论都好得多的预测。在明白并沿用了原子序之后,元素的排列有了确切的整数依据,在能够人工合成新元素的今天仍被广泛地使用。
周期性趋势
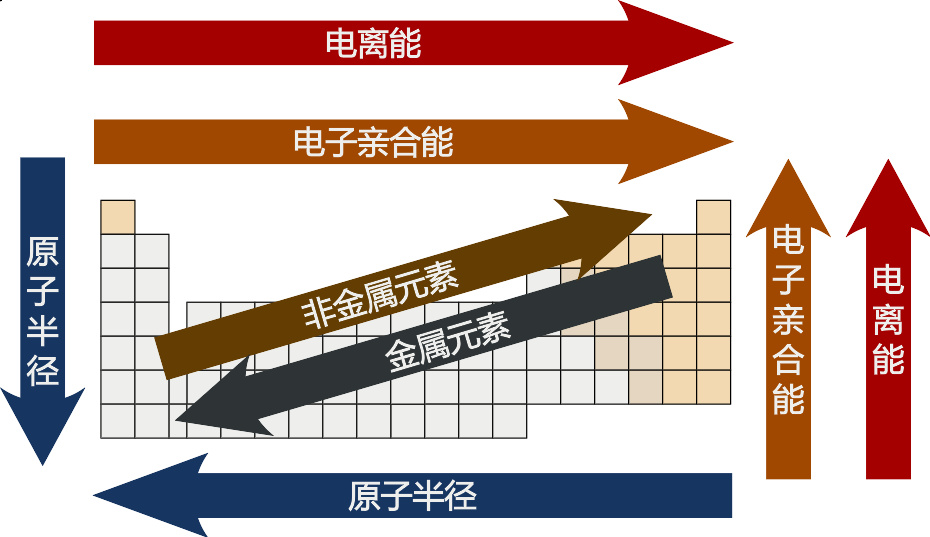
周期表中的一些趋势
一个元素的特性的主要决定因素是其电子排布,其中价电子壳层中的排布最为重要。譬如,p壳层有4颗价电子的元素会有类似的特性。原子最外层的电子所在的壳层将决定元素所属的“区”。价电子的数量则决定元素所属的“族”。 原子中电子壳层的数量决定元素的“周期”。每个壳层分为支壳层,而电子填充支壳层的顺序根据下表(构造原理), 并且决定了周期表的结构。由于外层电子决定化学特性,因此拥有相同数量的价电子的元素通常位于同一族内。
在同一族中的元素,随着原子量的增加,外层的电子(最容易参与化学反应)都位于同一种壳层中,壳层的形状相似,但能量和平均与原子核的距离逐渐增加。例如第一族的外层电子(价电子)从氢开始都是位于s壳层中。氢原子中的s壳层是任何原子中能够占据的最低能量的壳层,因此氢位于周期表的第一位。 钫是这一族中最重的元素,其外层电子位于第7壳层,比其他更低能量的电子壳层距离原子核更远。
注意随着原子序(质子数量)增加,原子核与电子之间会产生更强的自旋-轨道作用,降低了量子力学壳层模型的准确度,因为该模型假设每个壳层分别为一独立的物体。
族
“族”指的是周期表中的一列,并且是最重要的元素分类方法。在某些族里,各个元素之间有着相近的特性,并随着质量的增加有明显的趋势。根据国际命名系统,各族从左至右标1(碱金属)至18(惰性气体)。 旧有的命名系统在欧洲和美国有所差别(本节中的周期表用了旧有的美国命名系统)。
某些族还有非系统命名,如碱金属、碱土金属、卤素、氮族元素、氧族元素和惰性气体。但是其他的族,如7族元素,并没有额外的名称,因为这些族中元素特性的相似度不高,或趋势并不明显。
现代量子力学理论通过假设同一族中的元素在价电子壳层的排布相同,能够解释许多的族内趋势。
同族的元素在原子半径、电离能及负电性都有相同的模式。从上到下,族内元素的原子半径增加。由于填满的能级更多,因此价电子距离原子核更远。而元素的电离能则有下降的趋势,因为越远的电子越容易被移除。同样,负电性亦会下降,因为价电子和原子核的距离更远。
周期
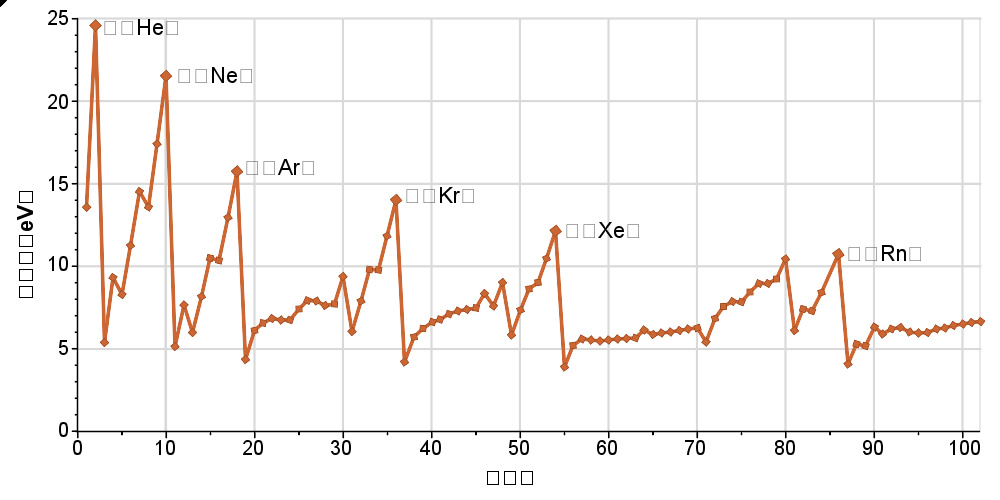
电离能的周期性趋势。每个周期从碱金属最低点开始,到惰性气体时达到最高点。
“周期”指的是周期表中的一行。虽然族是最常见的分类方法,但是有些元素的横向趋势比竖向趋势更为明显,如f区块中横向的镧系元素和锕系元素。
同一周期的元素在原子半径、电离能、电子亲和能及负电性都有趋势。周期中从左至右的元素原子半径一般降低,因为额外的一颗质子和一颗电子使电子距离原子核更近。 下降的原子半径也使电离能的增加,因为越紧的原子中所需移除电子的能量就越高。同样,更接近原子核的电子使元素的负电性增加。 一个周期中,电子亲和能也有一点趋势:左边金属一般比右边非金属的电子亲和能高,惰性气体除外。
区块
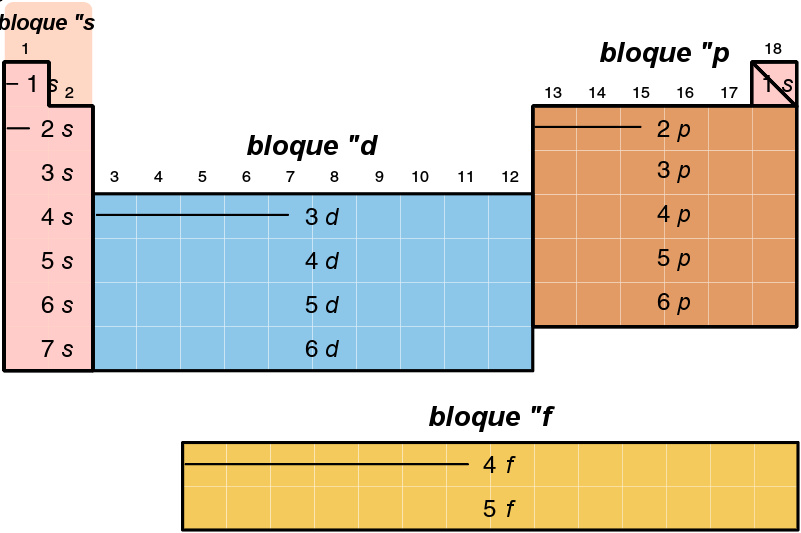
元素分区,使用美国的CAS编号法。
由于外层电子壳层的重要性,因此周期表中不同的区域有时被称为“区块”,根据最后一颗电子所在的支壳层命名。 首先,s区块包括首两族(碱金属和碱土金属),再加上氢和氦;p区块包括13至18族,其中包含了所有的类金属;d区块包含3至12族,其中包含所有的过渡金属;f区块通常整个显示在周期表的下方,包含所有的镧系元素和锕系元素。
变化
镧系元素和锕系元素两行一般显示在周期表主体的下方, 并在主体中留空两格,或以两个元素代替(镧或镥,及锕或铹),分别置于钡和铪之间,及镭和?之间。这项惯例的实行完全是因排版格式的缘故,而另一种不甚常见的周期表将镧系元素和锕系元素置于主体中相应的位置上,作为周期表的第6及第7行。

位于主体内的f区块
许多周期表沿着类金属画一条深色阶梯线,金属位于左边,而非金属位于右边。不同的元素分类有时也会表现在周期表上,如过渡金属、贫金属和类金属。另外也存在非正式的分类,如铂系元素和抗腐蚀金属,但在周期表中甚少注明。
其他周期表

现代的左排周期表,ADOMAH周期表
以上的周期表是最常用的一种, 但周期表也有其它的形式,除了各种矩形的之外,还包括圆形和圆柱体形的。这些周期表通常用以强调传统周期表中并不明显的元素特性。某些周期表注重于核子和电子结构,这能通过改变周期表中元素之间的相对位置来表现。另外的周期表强调人类提炼出纯元素的时序。
一种常见的另类形式为沙尔·珍奈的左排周期表,其中的元素根据电子壳层的填充排列。其现代版本ADOMAH周期表有助找出元素的电子排布,并和传统周期表呈90度角。当中的s区块位于惰性气体之后。
另一个常见的形式为Theodor Benfey的周期表,其中的元素以螺旋形排列。氢在中心,其它元素螺旋向外,而过渡金属、镧系元素和锕系元素为图中的“半岛”形。
另外还有三维的周期表,如Paul Giguere的周期表。四块平板互相连接,各代表一个区块,元素印在平板的正反面。氢和氦不在表内。
未来发展
尽管直到Og的所有元素都已被发现,但是只有直到?(108)和鿔有已知的物理和化学特性。其他的元素可能和趋势所预计的有所不同,因为超重元素的相对论性效应。譬如?有可能是一个惰性气体,虽然它属于碳族元素。
目前未知新的元素是否会延续周期表的格式,成为第8周期元素,还是需要更改排列方式。格伦·西奥多·西博格预计第8周期有两个s区块元素Uue(119)和Ubn(120)、其后18个g区块元素以及30个额外元素,延续已有的f、d和p区块。 另一方面,如Pekka Pyykkö等的某些物理学家提出,这些新的元素并不符合构造原理,并有着不同的电子排布原理,因此会影响在周期表中的排列方式。
理查德·费曼表示 粗略地理解相对论性狄拉克方程式得出的结论是,原子序大于137时,电子壳层会发生问题,所以在Uts之后不可能存在中性原子,根据电子排布整理的周期表在此处也因此瓦解。更严谨的分析得出极限在原子序等于173时发生。
根据玻尔模型的计算
玻尔模型在原子序大于137时出现问题,因为在电子壳层中电子的速度 v 为
其中 Z 为原子序, c 为光速, α 为精细结构常数。 在这个模型下, Z 大于137的原子中电子的速度会超过光速。因此在Z > 137时必须使用相对论性模型。
根据狄拉克方程式的计算
相对论性狄拉克方程式也在 Z > 137时瓦解,因为其基态能量为
其中 m 为电子的静止质量。当 Z > 137时,狄拉克基态的波函数是波动的,并且在正负能量范围之间没有空隙,形成与克莱因佯谬相似的情况 。考虑到有限原子核大小的更准确的计算指出,当 Z > Z cr ≈ 173时结合能超过电子静止时的能量的两倍。空缺的最内部壳层会导致一颗电子凭空产生,同时发射一颗正子。
参见
扩展元素周期表
门捷列夫
元素
化学:化学符号
化学元素:生命元素
元素列表
同位素
IUPAC元素系统命名法
参考文献
来源
Ball, Philip. The Ingredients: A Guided Tour of the Elements. Oxford University Press. 2002. ISBN 0-19-284100-9.
Gray, Theodore. The Elements: A Visual Exploration of Every Known Atom in the Universe. New York: Black Dog & Leventhal Publishers. 2009. ISBN 978-1-57912-814-2.
Kean, Sam. The Disappearing Spoon - and other true tales from the Periodic Table. London: Black Swan. 2010. ISBN 978-0-552-77750-6.
Levi, Primo. The Periodic Table [1975]. London: Penguin Books. 1984. ISBN 978-0-141-39944-7.
Mazurs, E.G. Graphical Representations of the Periodic System During One Hundred Years. Alabama: University of Alabama Press. 1974.
Moore, John. Chemistry For Dummies. New York: Wiley Publications. 2003: 111. ISBN 978-0-7645-5430-8. OCLC 51168057 .
Scerri, Eric. The periodic table: its story and its significance. Oxford: Oxford University Press. 2007. ISBN 0-19-530573-6.
Hjørland, Birger.The periodic table and the philosophy of classification. Knowledge Organization. 2011, 38 (1): 9–21 [ 2011-03-13 ] .
Bouma, J. An Application-Oriented Periodic Table of the Elements. J. Chem. Ed. 1989, 66 (9): 741.Bibcode:1989JChEd..66..741B. doi:10.1021/ed066p741 .
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

相关资料

- 有价值
- 一般般
- 没价值








24小时热门
推荐阅读



关于我们

APP下载



















