阿伏伽德罗常数
历史
阿伏伽德罗常数因阿莫迪欧·阿伏伽德罗得名,他是一名19世纪早期的意大利化学家,在1811年他率先提出,气体的体积(在某温度与压力下)与所含的分子或原子数量成正比,与该气体的性质无关 。法国物理学家让·佩兰于1909年提出,把常数命名为阿伏伽德罗常量来纪念他 。佩兰于1926年获颁诺贝尔物理学奖,他研究一大课题就是各种量度阿伏伽德罗常量的方法 。
阿伏伽德罗常量的值,最早由奥地利化学及物理学家约翰·约瑟夫·洛施米特(Johann Josef Loschmidt)于1865年所得,他透过计算某固定体积气体内所含的分子数,成功估计出空气中分子的平均直径 。前者的数值,即理想气体的数量密度,叫“洛施米特常数”,就是以他命名的,这个常数大约与阿伏伽德罗常量成正比。由于阿伏伽德罗常量有时会用 L 表示,所以不要与洛施米特(Loschmidt)的 L 混淆,而在德语文献中可能时会把它们都叫作“洛施米特常数”,只能用计量单位来分辨提及的到底是哪一个 。
要准确地量度出阿伏伽德罗常量的值,需要在宏观和微观尺度下,用同一个单位,去量度同一个物理量。这样做在早年并不可行,直到1910年,罗伯特·密立根成功量度到一个电子的电荷,才能够借助单个电子的电荷来做到微观量度。一摩尔电子的电荷是一个常数,叫法拉第常数,在麦可·法拉第于1834年发表的电解研究中有提及过。把一摩尔电子的电荷,除以单个电子的电荷,可得阿伏伽德罗常量 。自1910年以来,新的计算能更准确地确定,法拉第常数及基本电荷的值(见下文#测量)。
让·佩兰最早提出阿伏伽德罗数( N )这样一个名字,来代表一克分子的氧(根据当时的定义,即32克整的氧) ,而这个词至今仍被广泛使用,尤其是入门课本 改用阿伏伽德罗常量( N A )这个名字,是1971年摩尔成为国际单位制基本单位 后的事,因为自此物质的量就被认定是一个独立的量纲 。于是,阿伏伽德罗数再也不是纯数,因为带一个计量单位:摩尔的倒数(mol )。
尽管不用摩尔来量度物质的量是挺罕见的,但是阿伏伽德罗常量可用其他单位表示,如磅摩尔(lb-mol)或盎司摩尔(oz-mol)。
科学上的一般用途
阿伏伽德罗常数是一个比例因数,联系自然中宏观与微观(原子尺度)的观测。它本身就为其他常数及性质提供了关系式。例如,它确立了气体常数 R 与玻耳兹曼常数 k B 间的关系式,
以及法拉第常数 F 与基本电荷 e 的关系式,
同时,阿伏伽德罗常数是原子质量单位( u )定义的一部分,
其中 M u 为摩尔质量常数(即国际单位制下的1g/mol)。
测量
电量分析
最早能准确地测量出阿伏伽德罗常量的方法,是基于电量分析(又称库仑法)理论。原理是测量法拉第常数 F ,即一摩尔电子所带的电荷,然后将它除以基本电荷 e ,可得阿伏伽德罗常量。
国家标准技术研究所(NIST)的鲍瓦尔与戴维斯(Bower & Davis)实验 在这一方法中堪称经典 ,原实验中电解槽的阳极是银制的,通电后银会“溶解”,实验中电量计所量度的就是这些单价银离子所带的电量,电解液为过氯酸,内含小量过氯酸银。设电流的大小为 I ,通电时间为 t ,从阳极中离开的银原子质量为 m 及银的原子重量为 A r ,则法拉第常数为:
原实验中部分银原子会因机械性摩擦而脱落,而非通过电解,所以想通过银电极的消耗量来获得因电解而消耗的银原子质量 m ,就必须要解决摩擦造成的质量消耗问题,同时又不能大幅增加实验误差,为此NIST的科学家们设计出一种能补偿这个质量的方法:他们改在电解质中添加已知质量 m 的银离子,并使用铂制的阴极,银离子会在阴极上形成镀层,通过观测镀层来得知实验进程。法拉第常数的惯用值为 F 90 = 96,485.3251(12) C/mol ,对应的阿伏伽德罗常量值为 6.022 1 40 8 57(74) × 10 mol :两个数值的相对标准不确定度皆小于 1.3 × 10 。
电子质量测量
科学技术数据委员会(CODATA)负责发表国际用的物理常数数值。它在计量阿伏伽德罗常量时 ,用到电子的摩尔质量 A r ( e ) M u ,与电子质量 m e 间的比值:
电子的相对原子质量 A r ( e ),是一种可直接测量的量,而摩尔质量常数 M u ,在国际单位制中其大小是有定义的,不用测量。然而,要得出电子的静止质量,必须通过计算,其中要使用其他需要测量的常数 :
由下表2014年国际科学技术数据委员会(CODATA)的值 ,可见限制阿伏伽德罗常量精确度的主要因素,是普朗克常数,因为计算用的其他常数都相对地准确。
X射线晶体密度法(XRCD)
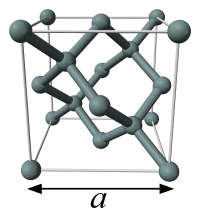
图为硅晶胞的球棒模型。X射线衍射可以测量到晶胞参数 a ,其数值可用于计算阿伏伽德罗常量的值。
运用X射线晶体学,是一种能得出阿伏伽德罗常量的现代方法 。现今的商业设备可以生产出单晶硅,产物有着极高的纯度,及极少晶格缺陷。这种方法把阿伏伽德罗常量定为一个比值,摩尔体积 V m 与原子体积 V atom 间的比值:
硅的晶胞有着由8个原子组成立方式充填排列,因此晶胞单元的体积,可由测量一个晶胞参数得出,而这个参数 a 就是立方的边长 。
实际上,所测量的距离叫 d 220 (Si),即密勒指数{220}所述的各平面间的距离,相等于 a 8 {\displaystyle {\tfrac {a}{\sqrt {8}}}} 。2010年CODATA的 d 220 (Si)数值为 192.015 5 714(32) pm ,相对不确定度为 1.6 × 10 ,对应的晶胞体积为 1.601 9 33 2 9(77) × 10 m 。
有必要测量样本的同位素成分比例,并在计算时考虑在内。硅共有三种稳定的同位素( Si, Si, Si),它们在自然界的比例差异,比其他测量常数的不确定度还要大。由于三种核素的相对原子质量有着确高的准确度,所以晶体样本的原子重量 A r 会经由计算得出。经由 A r 与测量出的样本密度ρ,可得求阿伏伽德罗常量所需的摩尔体积:
其中 M u 为摩尔质量常数。根据2014年CODATA的数值,硅的摩尔体积为12.058 832 14(61),相对标准不确定度为 5.1 × 10 。
根据2010年CODATA的推荐值,透过X射线晶体密度法所得出的阿伏伽德罗常量,其相对不确定度为 8.1 × 10 ,比电子质量法高,约为其一倍半。
国际阿伏伽德罗协作组织

图为澳洲精密光学中心的一名光学仪器专家,他手持的正是国际阿伏伽德罗协作组织的一千克单晶体硅制球体。
国际阿伏伽德罗协作组织(IAC),又称“阿伏伽德罗计划”,是各国计量局于1990年代初开始建立的协作组织,目标是透过X射线晶体密度法,将相对不确定度降低至低于 2 × 10 的水平 。这个计划是千克新定义计划的一部分,千克的新定义将会由通用的物理常数组成,取代现行的国际千克原器。而阿伏伽德罗计划同时会与称量千克原器的功率天平测量互补,共同提升普朗克常数的精确度 。在现行的国际单位制(SI)定义下,测量阿伏伽德罗常量,就是间接地测量普朗克常数:
测量对象是一个受过高度打磨的硅制球体,重量为一千克整。使用球体是因为这样做会简化其大小的测量(因此密度也是),以及将无可避免的表面氧化层效应最小化。最早期的测量,用的是有着自然同位素成分的硅球,常数的相对不确定度为3.1×10 。这些最早期的数值,与从瓦特秤来的普朗克常数测量结果并不一致,尽管科学家们认为他们已经知道差异的成因 。
早期数值的剩余不确定性,来源为硅同位素构成的测量,这个测量是用于计算原子重量的,因此在2007年种出了一4.8千克的同位素浓缩硅单晶(99.94% Si) ,然后从中切割出两个各一千克的球体。球体的直径测量在重复时相差小于0.3nm,重量的不确定度为3μg 。报告论文于2011年1月时发表,概括了国际阿伏伽德罗协作组织的研究结果,同时提交了对阿伏伽德罗常量的测量数值,为 6.022 1 40 7 8(18) × 10 mol ,与瓦特秤的数值一致,但更准确 。
参看
化学
常量
物质的量
阿伏伽德罗定律
“摩尔日”,美国化学家的节日,从10月23日早6:02到晚6:02,以纪念 N A
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

- 有价值
- 一般般
- 没价值








24小时热门
推荐阅读

关于我们

APP下载




























{{item.time}} {{item.replyListShow ? '收起' : '展开'}}评论 {{curReplyId == item.id ? '取消回复' : '回复'}}