氢键
成键
氢键通常可用X-H…Y来表示。其中X以共价键与氢相连,具有较高的电负性,可以稳定负电荷,因此氢易解离,具有酸性(质子给予体)。而Y则具有较高的电子密度,一般是含有孤对电子的原子,容易吸引氢原子,从而与X和H原子形成三中心四电子键。
键能
氢键键能大多在25-40kJ/mol之间。一般认为键能<25kJ/mol的氢键属于较弱氢键,键能在25-40kJ/mol的属强度等强度氢键,而键能>40kJ/mol的氢键则是较强氢键。 曾经有一度认为最强的氢键是[HF 2 ] 中的FH…F 键,计算出的键能大约为169kJ/mol。 而事实上,用相同方法计算甲酸和氟离子间的[HCO 2 H…F ]氢键键能,结果要比HF 2 的高出大约30kJ/mol。
常见氢键的平均键能数据为:
F—H … :F (155 kJ/mol 或 40 kcal/mol)
O—H … :N (29 kJ/mol 或 6.9 kcal/mol)
O—H … :O (21 kJ/mol 或 5.0 kcal/mol)
N—H … :N (13 kJ/mol 或 3.1 kcal/mol)
N—H … :O (8 kJ/mol 或 1.9 kcal/mol)
HO—H … :OH 3 (18 kJ/mol 或 4.3 kcal/mol)
成键原子
典型的氢键中,X和Y是电负性很强的F、N和O原子。但C、S、Cl、P甚至Br和I原子在某些情况下也能形成氢键 ,但通常键能较低。
碳在与数个电负性强的原子相连时也有可能产生氢键。例如在氯仿CHCl 3 中,碳原子直接与三个氯原子相连,氯原子周围电子云密度较大,因而氢原子周围即带有部分正电荷,碳也因此参与了氢键的形成,扮演了质子供体的角色。
芳香环、碳碳叁键或双键在某些情况下都可作为电子供体,与强极性的X-H(如-O-H)形成氢键。
方向
X-H…Y不需要,也往往不是严格的直线。 哪怕不算分叉的氢键,一对一的氢键中也有很多键角处在150°-180°之间的情况,氟化氢长链中的氢键即是一例。
对称氢键
通常氢是通过共价键与X原子相连,并通过较长和较弱的“氢链”与Y原子连接,即使X与Y是相同的元素,X-H和H…Y距离也往往不相等。但在M HA 2 型的酸式盐中,其中A是F 或某些有机酸(如乙酸和苯甲酸),氢原子恰好处于X和Y原子的中心(X-H…Y)。这一类例子被称作 对称氢键 ,它们往往键能较大,键长较短。
对称氢键和不对称氢键的现象往往难以解释。一个比较认同的解释是,将FHF 离子中的氢键看成氢桥,类似于乙硼烷中的BHB硼桥键。只不过硼桥键是三中心两电子键,而氢桥键是三中心四电子键。
双氢键
1995年以来,报道了许多种分子间存在一种被称为双氢键的新型分子间力,可用通式AH…HB表示。 双氢键的键长一般小于220pm,极限可能为270pm,键能从n~n*10kJ/mol不等,相当于传统分子间力能量数量级。双氢键的一些例子包括:BH 4 …HCN、BH 4 …CH 4 、LiH…NH 4 、LiH…HCN、LiH…HC≡CH,CH 4 …H-NH 3 和H-Be-H…H-NH 3 等,其中以BH 4 …HCN双氢键的键长为最短(171pm),键能也最高(75.44kJ/mol),远大于水和HF间的氢键键能。目前对双氢键的研究还不是很深入。
影响

液态水模拟图。照片中心的分子引出的的蓝色虚线代表氢键。
氢键的影响包括:
与同族的化合物相比,NH 3、H 2 O和HF具有反常高的熔点和沸点。
氨在水中的非常大的溶解度与它和水分子间的氢键有关。
甘油、无水磷酸和硫酸具有较大的黏度。
邻硝基苯酚中存在分子内氢键,因此熔点较间硝基苯酚和对硝基苯酚低。
冰中水分子在冰晶体结构中空间占有率较低,因而冰密度较小,甚至小于水。
分子内形成氢键常使酸性增强。如苯甲酸的Ka=96.2×10﹣¹²,而邻羟基苯甲酸的Ka=9.9×10-¹¹,2,6-二羟基苯甲酸可在分子内形成两个氢键,它的Ka=5×10﹣9。其原因是分子内氢键的形成,促进了氢的解离。
结晶水合物中存在由氢键构建的类冰骨架,其中可装入小分子或离子。参见甲烷气水包合物。
C=O…H-N氢键使蛋白质形成α螺旋。
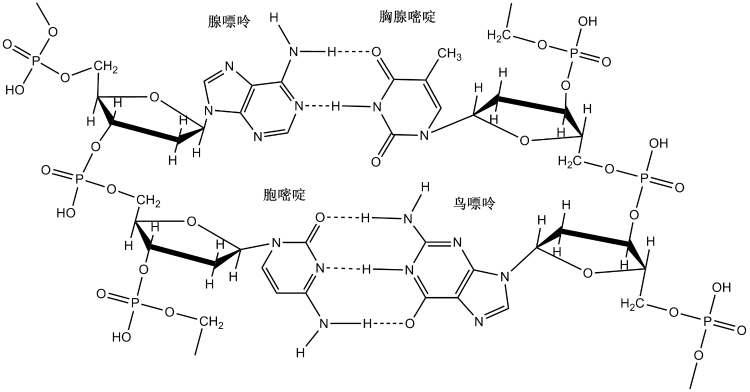
DNA(脱氧核糖核酸)中两条链的碱基通过氢键配对,而氢键的饱和性和方向性使得双螺旋的碱基配对具有专一性,即A-T靠2个氢键配对而C-G靠3个氢键配对,如下图:
参见
分子间作用力
范德华力
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

相关资料
展开
- 有价值
- 一般般
- 没价值








24小时热门
知识互答
关于我们

APP下载

























{{item.time}} {{item.replyListShow ? '收起' : '展开'}}评论 {{curReplyId == item.id ? '取消回复' : '回复'}}