d轨道
命名
d轨道的“d”是“diffused”,其为“漫系光谱”之意。
结构
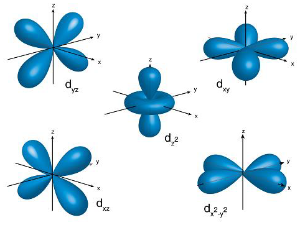
五种d轨道的形状,除了 d z 之外,其他四个形状相同,只是方向不同
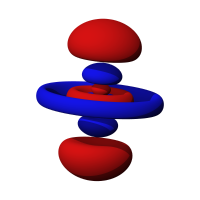
5d轨道模型,红色和蓝色中间空隙则为波节
d轨道从主量子数n=3开始出现,最小的d轨道是3d轨道,也就是说1d、2d轨道不存在,当角量子数为2时,其轨道为d轨道,主量子数不可小于三,对应于五个磁量子数2、1、0、-1、-2,在3d轨道中,有五个能量相同的3d轨道,同样的,主量子数为4以上时也有五个4d轨道,因此,每个壳层都有五个d轨道,它们分别为 d z 、 d x -y 、 d xy 、 d yz 、 d xz ,但是没有 d x 、 d y 、 d y -z 、 d x -z 。在存在的五个d轨道( d z 、 d x -y 、 d xy 、 d yz 、 d xz )中,有四个形状相同,分别为: d x -y 、 d xy 、 d yz 、 d xz 但方向不同,而 d z 是五个d轨道中形状与众不同的一个,尽管如此, d z 轨道仍具有和 d x -y 、 d xy 、 d yz 及 d xz 相同之能量。
4d、5d、6d轨道可视为性质与3d轨道相似,只是大小比较大,其与p轨道类似,也有“正负性”,这些“正负性”变化在原子轨道彼此形成化学键时非常重要。
d轨道一样有波节面,类似于p轨道的形式,但 d z 轨道中间的部分较特别,是一个环状结构像外的波,但电子出现概率和s轨道相反,例如 4d z 轨道的中间部分:在靠近原子核之处电子出现概率几乎是0,然后开始增加,出现一个较高电子出现概率的环状区域,但继续向外看之后,随即降为0,接着又增加,出现一个更大的较高电子出现概率的环状区域,然后在距离原子核甚远的地方又为0,而上下的双哑铃形的结构则与p轨道相同。
电子波
5个d轨道的角量子数ℓ=2。角部分的d轨道经常会表示为:
的d轨道角部分的三次谐波为 X 2 c ( r ) {\displaystyle X_{2c}({\mathbf {r}})}
和
能级交错
d轨道有能级交错现象。例如,3d的能量似乎应该低于4s,而实际上E 3d >E 4s 。按能量最低原理,电子在进入核外电子层时,不是排完3p就排3d,而是先排4s,排完4s才排3d。
性质
d轨道在半填满和全填满时较稳定,因此,许多过渡金属倾向于失去d轨道的电子直到其成为半填满为止,如铁,原价电子组态为3d 4s ,失去s轨道后还会再放出1个d轨道电子,使其成为Fe ,组态为:3d ,此时d轨道半填满,因此Fe 较稳定,这也是为何Fe 离子倾向于变成Fe 离子的原因。
d轨道
在周期表中,过度金属的价轨道是d轨道,除了内过度金属,另外,除了前三周期之外,大部分的非金属的价壳层之d轨道是填满的。
d区元素
d区元素是指这些元素中具有最高能量的电子是填在d轨道上的,是元素周期表中的副族元素,即第3至第12族元素。这些元素有时也被称作过渡金属。
参考文献
书籍
曾国辉《原子结构》建宏出版社 台北市 1999 ISBN 957-724-801-2
参见
s轨道
p轨道
f轨道
原子轨道
d区元素
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

相关资料
展开
- 有价值
- 一般般
- 没价值








24小时热门
推荐阅读

知识互答
关于我们

APP下载


























{{item.time}} {{item.replyListShow ? '收起' : '展开'}}评论 {{curReplyId == item.id ? '取消回复' : '回复'}}