极性
共价键的极性
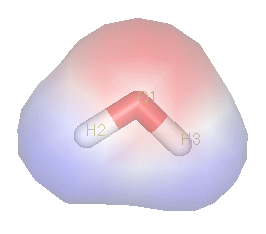
水是极性化合物。由于氧原子强烈的电负性,电子对明显偏向氧一侧,因此氧周围聚集负电荷(红色部分),氢原子周围聚集正电荷(蓝色部分)。
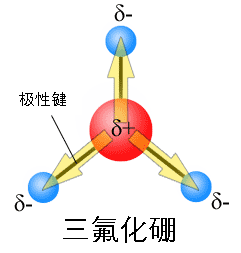
三角形的三氟化硼分子。尽管3根键都是极性键,但分子是非极性分子。因为分子对称,正负电荷中心重合了。
共价键的极性是因为成键的两个原子电负性不相同而产生的。电负性高的原子,如氟、氧及氮,比电负性低的原子更能吸引电子,即把电子“拉”向它那一方,而电子接近电负性高的原子的时间也较多,使得电荷不均匀分布。这样形成了一组偶极,这样的键就是极性键。电负性高的原子是负偶极,记作δ-;电负性低的原子是正偶极,记作δ+。
键可以堕入两个极端——极性和非极性。当构成共价键的不同离子的电负性完全相同,便会产生完全非极性的键。相反,当两者的电负性相差值大得足以令其中一种离子完全取走了另一方的一粒电子,就会产生极性键——或更贴切而言,是离子键。“极性”和“非极性”二词多用于形容共价键上。 键的极性程度可以用两个原子电负性之差来衡量。差值在0.4到1.7之间的是典型的极性共价键,差值在0.0到0.4之间的是非极性共价键,两个原子完全相同(当然电负性也完全相同)时,差值为0,这时原子间成非极性键。
分子的极性
一个共价分子是极性的,是说这个分子内电荷分布不均匀,或者说,正负电荷中心没有重合。分子的极性取决于分子内各个键的极性以及它们的排列方式。在大多数情况下,极性分子中含有极性键,非极性分子中含有非极性键。
然而,非极性分子也可以全部由极性键构成。只要分子高度对称,各个极性键的正、负电荷中心就都集中在了分子的几何中心上,这样便消去了分子的极性。这样的分子一般是直线形、三角形(又因三个原子处于同一平面而称作平面型)或正四面体形。
分子形状
参见价层电子对互斥理论。 分子的形状是在组成分子的各原子以及其中某原子的未成键电子的相互排斥作用下形成的。未成键电子对化学键的排斥力大于化学键之间的相互排斥力。如二氧化碳(CO 2 ),其中的碳原子和氧原子均达到了八电子稳定结构且所有电子均成键,所以没有额外电子,又因双键的原因碳原子和氧原子都在一条直线上,所以二氧化碳是直线型分子。而氨气(NH 3 ),因为氮原子有一对电子未成键,所以对三对氮氢化学键有较大排斥力,因此氨气分子是三角锥形,而不是平面型或正四面体型。
分子极性的推测
分子极性对性质的影响
溶解性
分子的极性对物质溶解性有很大影响。极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂,也即“同类互溶”。蔗糖、氨等极性分子和氯化钠等离子化合物易溶于水。具有长碳链的有机物,如油脂、石油的成分多不溶于水,而溶于非极性的有机溶剂。
熔沸点
在分子量相同的情况下,极性分子比非极性分子有更高的沸点。这是因为极性分子之间的取向力比非极性分子之间的色散力大。
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

相关资料
展开
- 有价值
- 一般般
- 没价值








关于我们

APP下载