乳糖操纵子
操纵子结构
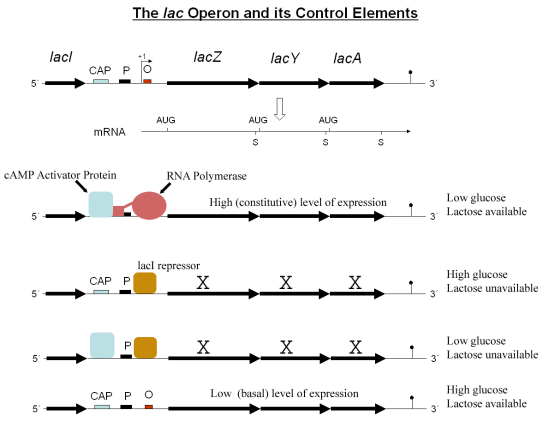
乳糖操纵子包含三个结构基因、启动子、终止子及操纵基因。这三个结构基因称为 lacZ 、 lacY 及 lacA 。 lacZ 编码β-半乳糖苷酶,这是一种将双糖乳糖水解为葡萄糖与半乳糖两个单糖的酶。 lacY 编码β-半乳糖苷透性酶,这是一种在细胞膜的运送蛋白质,负责将乳糖逼入细胞中。 lacA 编码β-半乳糖苷乙酰基转移酶,这是一种酶将乙酰基从乙醘辅酶A转移至β-半乳糖苷。当中只有 lacZ 及 lacY 在乳糖的分解代谢是必须的。
乳糖操纵子基因的独特控制受细菌乳糖底物的存在影响。当乳糖不作为唯一碳源存在时,细菌就不会产生蛋白质。乳糖操纵子基因会组成操纵子:它们会在染色体附近被导向成同一方向,并会一并转录成单一多基因性的mRNA分子。所有基因的转录会由RNA聚合酶(一个DNA结合蛋白)与一个位于基因上游独特的DNA结合位点结合开始,这个位点称为启动子。由这个位点开始,RNA聚合酶会开始转录所有三个基因( lacZYA )为mRNA。大肠杆菌乳糖操纵子的DNA序列(lacZYA mRNA)及 lacI 基因都在基因库中可以找到。 .
对乳糖的调控反应需要一个细胞内的调节蛋白,称为乳糖阻遏物。 lacI 基因会为位于乳糖操纵子附近的阻遏基因编码,并且会表现出来。如果在生长环境中缺乏乳糖,阻遏物会紧密地与位于启动子下游接近 LacZ 的短DNA序列(称为乳糖操纵基因)结合。与操纵基因结合的阻遏物会干扰RNA聚合酶与启动子的结合,所以mRNA可以在很低水平的情况下为LacZ及LacY编码。当细胞在有乳糖的环境下成长时,称为异乳糖的乳糖代谢物会与阻遏物结合,容许RNA聚合酶转录乳糖基因,并从而引发高水平的编码蛋白。
以下的图片总结了以上的反应。
遗传学命名法
细菌显型,包括大肠杆菌在内,都会用三个字母来描述。就如Lac是指使用乳糖的能力、His就是指合成组氨酸的能力、Mot是指运动力及Str是指对链霉素的反应。在Lac的情况下,野生型细胞都是Lac 及能够使用乳糖作为碳源及能源;而Lac 突变体则不能使用乳糖。相同但细阶的字母一般都会用来标示涉及特定显型的基因,而每一个不同的基因就会额外加上一个分别的字母。而替 lac 基因编码的酶就是 lacZ 、 lacY 及 lacA 。第四种 lac 基因是 lacI ,是用来为乳糖阻遏基因编码:I代表可诱导性。这样可以分别结构基因编码酶及影响基因表达的调控基因编码酶。现时这种命名法亦适用于蛋白质上:如LacZ就是 lacZ 基因β-半乳糖苷酶的产物。多种短序列并非基因亦会影响基因表达,包括 lac 启动子( lac p )及 lac 操纵基因( lac o )。虽然这并非一般的用法,突变体的 lac o 因历史关系会称为 lac o 。
乳糖类似物
取代半乳糖苷
一系列的乳糖衍生物或类似物被认为协助乳糖操纵子的工作。这些化合物主要是取代半乳糖苷,当中乳糖的葡萄糖部分被其他官能团所取代:
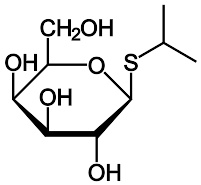
异丙基-β-D-硫代半乳糖苷
异丙基-β-D-硫代半乳糖苷(简称IPTG)是经常在均生理学上被用来作为乳糖操纵子的诱导物。 IPTG与阻褐基因结合并使之不活跃,但却非β-半乳糖苷酶的基底。IPTG在体内研究的一个优点是它不能被大肠肝菌所代谢,所以细胞的生长率在实验中并非变数。再者,IPTG能在缺乏 lacY 基因下而有效地被运送。并且,由于细胞不会代谢IPTG,它的浓度在实验中并不会改变。
苯基-β-D-半乳糖(简称phenyl-Gal)是β-半乳糖苷酶的基底,但不会阻止阻褐基因,所以并不是诱导物。由于野生型细胞生产非常少量β-半乳糖苷酶,它们不能倚靠phenyl-Gal作为碳源及能源来生长。缺乏阻褐基因的突变体可以在phenyl-Gal上生长。所以,在只有极微量phenyl-Gal的环境,对阻褐基因突变体及操纵基因突变体是有选择性的。若10 的野生型细胞在含有phenyl-Gal的培养基中生长,那少量的植菌都主要是影响阻褐基因的突变体。阻褐基因突变体及操纵基因突变体的相对分布是被目标尺寸所影响,即每种突变所产生的DNA的不同变化数量。由于 lacI 基因编码阻褐基因是约操纵基因的50倍,阻褐基因突变体会支配选择。
指示剂
其他化合物则作为β-半乳糖苷酶活动的颜色指示剂:
邻硝基苯基-β-D-半乳糖苷(简称OG)会被分开来产生黄色的化合物:邻硝基苯基。它一般会被用来作为β-半乳糖苷酶试管分析的基底。
5-溴-4-氯-3-吲哚-α-D-半乳糖苷(简称X-gal)会将产生β-半乳糖苷酶的殖菌转为蓝色。
异乳糖
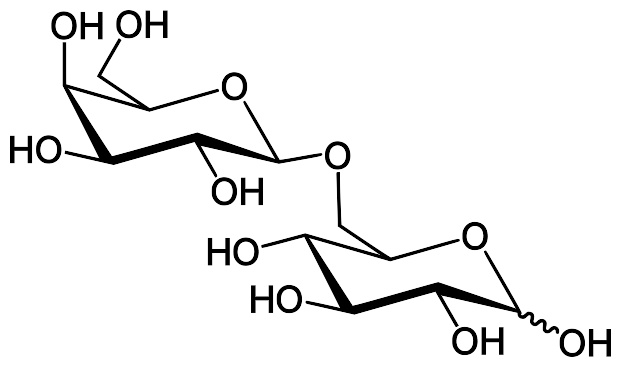
异乳糖
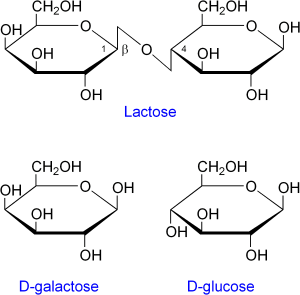
异乳糖是乳糖的异构体,且是乳糖操纵子的诱导物。乳糖是半乳糖-(β1->4)-葡萄糖,而异乳糖则是半乳糖-(β1->6)-葡萄糖。乳糖会被β-半乳糖苷酶在非水解反应中转变成异乳糖。
要显示LacZ在产生真正大肠杆菌细胞的诱导者的角色,可以从观测当在IPTG环境(非乳糖)下生长时,在没有突变体的 lacZ 仍可产生LacY透性酶。这是因在处理乳糖成为异乳糖的过程是需要在细胞内产生诱导物。
调控突变体的分类
方斯华·贾克柏及贾克·莫诺在概念上的突破是辨认调控物质及它们改变基因表达的位点的分别。 前身为一位士兵的贾克柏就以一个轰炸机作为类比:当轰炸机收到特别的无线电传送或讯号时,就会释放它那些致命的货物。这个系统需要一个地上的发讯器及一个机上的接收器。若发讯器被破坏,这个系统可以透过使用另一个发讯器来继续运作。相反,若轰炸机上的接收器是坏掉的,这就不可能更换另一架轰炸机。
为分析乳糖操纵子的调控突变体,贾克柏发展了一套系统将 lac 基因的复制本(即 lacI 连它的启动子,与 lacZYA 连启动子及操纵基因)引入一个细胞内。这样生殖的细菌,一是 lac 基因有双倍数量,或是正常的,并且会测试它们的调控显型。特别地考虑的是LacZ及LazY在没有IPTG下仍能被制造。这个实验由于是以一对一对的基因来测试,故是为一种基因互补作用。
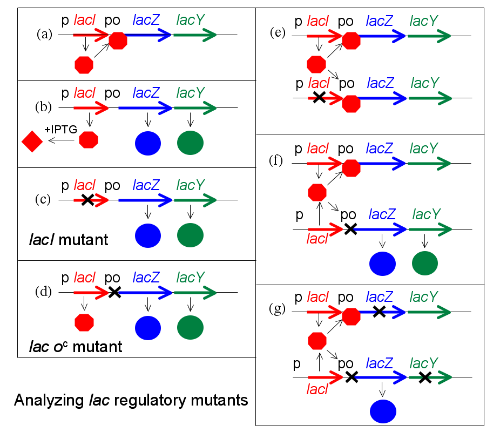
在上图中显示了这个实验,当中为简便而略去 lacA 。首先显示了某些单倍体,即细胞只带有单一的 lac 基因复制本。(a)表示了基因表达,(b)表示了IPTG的诱导,而(c)及(d)分别地表示了 lacI 基因及操纵基因突变的影响。在(e)中表示了阻褐基因的互补作用。若一个 lac 基因的复制本带有 lacI 的突变体,但另一个复制本是 lacI 的野生型,得出的显型会是正常,即缺乏IPTG下没有LacZ表现。影响阻褐基因的突变体被称为对野生型的“隐性”(而该野生型则是显性),这是因阻褐基因是一细小的蛋白质可以渗透入细胞。邻接损坏的 lacI 基因的乳糖操纵子复制本会有效地被 lacI 另一复制本所产生的蛋白质所阻碍。
若在相同的实验使用操纵基因突变体,将会得出一个不同的结果((f))。带有一个突变体及一个野生型操纵基因位点的细胞显型会在缺乏诱导物IPTG下仍能产生LacZ及LacY。操纵基因突变体是显性。当与阻褐基因结合的操纵基因位点受到突变的破坏时,另一个在细胞内有效的位点会继续进行基因表达。
这个实验最尖端的地方是使用有标记的操纵子来分别两个 lac 基因的复制本,从而显示了没有调控的基因就是位于突变操纵基因旁边((g))。例如,假设其中一个复制本是以不活跃 lacZ 的突变来作标记,使之只能生产LacY蛋白质;而另一个复制本带有影响 lacY 的突变体,而只能生产LacZ。在此,只有邻接突变操纵子的乳糖操纵子的复制本会在缺乏IPTG下被表现。这种操纵基因突变被称为“顺势显性”,即对野生型带有显性但只会影响与之邻接的操纵子。
但是,这个实验的重要性却容易令人误解。因为它先描述了实验,然后对实验结果进行了解释。但事实上是先有的模型,然后为验证模型而做的实验。贾克柏及莫诺首先以操纵基因的特征想象DNA位点的存在,并设计这个实验来作出证明。
操纵基因突变体的显性亦显示了选择它们的步骤。若从野生型中以phenyl-Gal选择了调控突变体,操纵基因突变体则很难与阻褐基因突变体作出比较,原因是目标数量太少。但若从带有两个 lac 基因复制本的菌株开始,则阻褐基因突变体不会复原,这是因野生型基因会产生野生型显型。相反,操纵基因突变体会较多。
环一磷酸腺苷调节
方斯华·贾克柏及贾克·莫诺使用的微生物是在实验室很普遍的大肠杆菌,但很多发现的基本调控观念都是其他生物细胞调控的基础。当中最主要的,就是蛋白质并不是当它们需要时才合成的:大肠杆菌为保存细胞资源及能量,在不需要代谢乳糖的情况下(如当其他糖,包括葡萄糖存在时),不会生产那三种Lac蛋白质。最重要的问题是大肠杆菌如何控制基因来反应代谢的需要。
当第二次世界大战时,莫诺测试了多种糖组合作为大肠杆菌的效用。他发现细菌在两种不同的糖下会有两个阶段的生长。例如,若同时提供葡萄糖及乳糖时,葡萄糖会被首先代谢(第一生长阶段,见图2),而接着是乳糖(第二生长阶段)。这种现象称为二次生长。
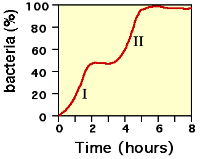
图2:莫诺的二次生长曲线
乳糖的代谢并不会在二次生长曲线的第一部分出现,因为当葡萄糖及乳糖都同时存在时,β-半乳糖苷酶并未制造。
这个生长曲线的解释并非如经典模型所述,却是由于额外的 lac 基因突变体所造成。另外两种基因( cya 及 crp )的突变体当在IPTG环境下会令基因表达下降,纵然是带有阻褐基因或操纵基因突变体的菌株。于1957年在真核生物上及十年后在大肠杆菌发现环一磷酸腺苷(cAMP)后,显示了透过加入cAMP,可以对这其中一种基因造成突变损坏,并使菌株回复至完全活动。
cya 基因为制造cAMP的腺苷酸环化酶编码。而 cya 突变体在缺乏cAMP下使 lacZYA 基因的表现比正常下降十倍。加入cAMP可以修正这种 cya 突变体低Lac表现的特征。另一个基因 crp 为一种称为代谢产物激活蛋白(简称CAP)或代谢产物阻遏蛋白(简称CRP)编码。
这种双重调控降低乳糖代谢酶的生产,而乳糖阻碍了LacI与操纵基因的结合。但当高cAMP浓度时,在存有乳糖的环境下,就会出现高度的表现。为了要容许在葡萄糖消耗后,一些乳糖可以在 lac 表现完全活跃前得到代谢,这种少量的酶生产是必须的。
总括而言:
当缺乏乳糖时,就会生产少量的酶(操纵基因与LacI结合)。
当存有乳糖,而同时亦有其他首选的碳源(如葡萄糖)时,就会生产少量的酶(LacI没有与操纵基因结合)。
当乳糖是首选的碳源时,cAMP-CAP会与启动子结合,而Lac酶的生产会最大化。
但为何在两个生长阶段之间会有一段阻延呢?首先,CAP调控蛋白需要在 lac 操纵基因上组合,以增加生产 lac 的mRNA。更多的 lac mRNA复制本须在大量LacZ及LacY复制本下生产。经过一段时间后,乳糖代谢酶的水平上升,细菌会进入新的急速生长期。
代谢产物阻遏产生两个难题,就是怎样cAMP水平实际地加入葡萄糖的环境中,而另一个则是为何细胞须平均处理。当乳糖在分开后,它其实是葡萄糖及半乳糖。在代谢上来说,乳糖与葡萄糖同样是一个好的碳源及能源。cAMP水平不是与细胞内的葡萄糖水平有关,却是与葡萄糖运送率有关,并影响着腺苷酸环化酶。再者,葡萄糖运送亦导致阻碍乳糖透性酶。为何大肠杆菌会以此运作,这只能作出猜测。所有肠道菌科细菌将葡萄糖及酵,这表示它们经常处理葡萄糖。这可能是在运送或代谢乳糖上会产生小许分别,并使细胞这样来调控乳糖操纵子。
阻遏基因的多聚性质
乳糖抑制子是一个由完全一样的子单元合成的四聚物。每一个子单元包含一个能与DNA结合的螺旋缠绕螺旋的基本图形。与阻遏基因结合的操纵基因位点是一个有着倒转重复对称的DNA序列。这两个操纵基因的DNA半位点会与四聚物阻遏基因的子单元结合。虽然其他两个子单元并不会做任何事,但其原因很多年来却不清楚。
但最后发现的是两个额外的操纵基因都会涉及调控 lac 。其中一个(O 3 )在 LacI 基因的尾巴,而其他(O 2 )约位于 lacZ 早段下游的400 bp位置上。这两个位点在早期的研究上并未被发现,因为它们有着多余的功能及个别的突变并不太会影响阻遏。对于O 2 或O 3 的个别突变只有两或三叠的影响。但是O 2 及O 3 同时的突变会明显地减低阻遏(约为70叠)。
在现时的模型,阻遏基因是同时与主要操纵基因O 1 及O 2 或O 3 结合。介入的DNA从复合物循环向外。这两个操纵基因的多余性质显示了它们并非独特重要的循环复合物。这个系统的运作是透过系链来促成。若已结合的阻遏基因暂时从O 1 释放,与另外的操纵基因结合可以将它维持在附近,并可以立刻重新结合。这可以增加O 1 阻遏基因的亲和力。
诱导机关
阻遏基因是一个异构蛋白。阻遏基因在其中一个形式是能够与操纵基因结合,而在另一个形式则不能。根据传统的诱导的模型,诱导物,无论是异乳糖或IPTG与阻遏基因的结合都会影响阻遏基因在这两种形式的分布。所以,带有诱导物的阻遏基因可以在非DNA结合构造中被稳定。但是,简单的模型却不能提供全面解释,因为阻遏基因与DNA的结合较牢固,但却在加入诱导物后经常被释放。所以很明显的阻遏基因亦可以在与DNA结合的同时与诱导物结合。但结合的机关却仍不太清楚。
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

相关资料

- 有价值
- 一般般
- 没价值








24小时热门
推荐阅读
关于我们

APP下载



























{{item.time}} {{item.replyListShow ? '收起' : '展开'}}评论 {{curReplyId == item.id ? '取消回复' : '回复'}}