酮
命名
简单的酮常用普通命名法。
芳香酮中芳基作为取代基来命名。
多元酮命名时,应选取含羰基尽可能多的碳链作主链,并标明羰基的位置和羰基的数目。
不饱和酮的命名除羰基的编号应尽可能小以外,还要表示出不饱和键所在的位置。
脂环酮命名时,编号从羰基碳原子开始,仅在名称前多加一个“环”字。
很多天然酮都有俗名,例如,天然麝香的主要成分麝香酮(muscone)为十五元环酮等。
结构和性质
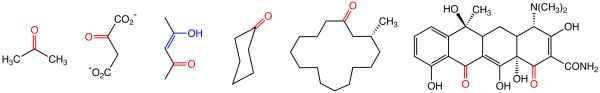
具有代表性的酮,从左到右:丙酮,一种常规溶剂;草酰乙酸,糖代谢中间体;乙酰丙酮的单烯醇式(烯醇部分蓝色标注);环己酮,尼龙的前体;麝香酮,一种动物香料;四环素,一种抗生素。
酮中的羰基碳原子为sp 杂化,平面三角构型,其C-C-O和C-C-C键角约为120°。
羰基中氧原子的电负性高于碳原子的电负性,故羰基有极性,氧原子具亲核性,碳原子具亲电性。由于羰基能够与水形成氢键,酮分子比羰基置换成亚甲基的分子来说更易溶于水。酮一般只作氢键受体而不作为氢键供体,无法形成自身份子间的氢键,因而比具有类似分子量的醇和羧酸更具挥发性。酮类是常用的香水和溶剂组分。
酮的分类
酮可根据其所含取代基分类,也可根据羰基两侧取代基是否相同而分类为对称和不对称的酮。丙酮和苯酮属于对称酮;苯乙酮(C 6 H 5 C(O)CH 3 )则属于不对称酮。立体化学中,不对称酮被视为前手性分子。
按照烃基的不同,酮还可分为脂肪酮,脂环酮和芳香酮。芳香酮的羰基直接连在芳香环上。
按照羰基的数目,酮可以分为一元酮和多元酮。
最简单的二酮是丁二酮(CH 3 C(O)C(O)CH 3 ),它曾被用作爆米花中的奶油增味剂。分子对称的乙酰丙酮(2,4-戊二酮)虽称为二酮,但它主要以单酮烯醇式存在,此烯醇式是配位化学中的常见配体。
不饱和酮多指含有烯烃和炔烃结构的酮类。例子有甲基乙烯基酮(CH 3 C(O)CH=CH 2 ),Robinson环化中的重要中间体。酮官能团自身也是不饱和的,多数情况下可通过氢化还原。
无杂原子取代的饱和单环环酮母核的分子式为(CH 2 ) n CO,其中n=3(环丙酮)-10。环己酮是生产尼龙的前体。异佛尔酮为不饱和的非对称酮,用于聚合物的制备。麝香酮是一种动物信息素。
酮-烯醇异构
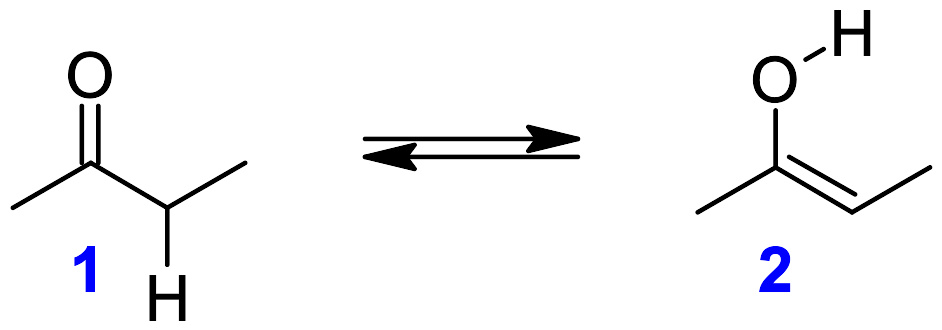
酮-烯醇异构。 1 酮型; 2 烯醇型。
至少有一个α-氢的酮可发生酮-烯醇异构化,产生对应的烯醇。异构化可以被酸或者碱催化进行。通常酮式比烯醇式更稳定,因此可以利用平衡通过炔烃的水解反应来制备酮。
酮的酸性
酮的α-氢的酸性(pKa≈ 20)比一般的烷烃氢的酸性(pKa ≈ 50)强的多。这是因为酮被去质子化后形成的烯醇离子具有一定的稳定性。等当量碱夺取α-氢后产生的烯醇离子,为两位负离子,可在亲核性较强的碳原子一端也可在碱性较强的氧原子一端参与亲核取代反应,在合成上十分有用。
表征
光谱
在红外光谱,酮和醛于1700cm −1附近有强烈吸收。具体吸收位置取决于分子中的其他官能团。
酮在核磁共振氢谱中难以确认,在核磁共振碳谱中羰基碳则位于低场约200ppm的位置。因无核极化效应,故信号峰一般较弱。醛和酮在核磁共振中具有相似的化学位移,需通过多重共振实验进行辨别。
有机定性实验
酮的Brady试验结果呈阳性,可与2,4-二硝基苯肼缩合为相应的腙。Tollens试验中酮呈阴性,可借此性质而将酮与醛区分开。甲基酮可通过卤仿反应鉴别。
合成
酮可通过多种方法合成。工业中,酮多通过烃类被氧化制备,氧化剂一般是空气(中的氧气)。例如每年产量十亿公斤的环己酮即是通过环己烷被空气氧化而制备的。而丙酮则是通过异丙苯氧化法来制备的。
实验室中,酮一般通过二级醇的氧化制备。
高锰酸钾与六价铬试剂(如重铬酸钾)是典型的氧化剂。此外还有比较温和的条件如:使用Dess-Martin氧化或Moffatt-Swern氧化。
许多发展出来的其他常用合成方法包括:
通过偕卤素水解制备。
通过炔烃的水解制备。反应经烯醇中间体,需硫酸汞催化。得到的烯醇异构化为酮。这个反应通常是利用末端的炔烃来合成酮。
通过计量的有机金属试剂与Weinreb胺反应。
芳基酮可以通过Friedel-Crafts酰化及相关的Houben-Hoesch反应或Fries重排制备。
烯烃臭氧化或二羟化-氧化(如Sharpless不对称双羟基化反应),可使烯烃断裂为醛或酮。产物取决于烯烃的双键取代类型。
Kornblum–DeLaMare重排中,酮通过过氧化物与碱反应制备。
Ruzicka环化中,环酮通过二羧酸制备。
Nef反应中,酮通过二级硝基化合物的盐的水解制备。
Fukuyama偶联中,酮通过硫酯和有机锌化合物制备。
通过酰氯与有机镉化合物或有机铜化合物反应制备酮。
Dakin-West反应提供了一种有效的从羧酸来制备酮的方法。
酮亦可通过格氏试剂与腈反应然后水解来制备。
通过酸酐脱羧来制备。
酮可通过卤代酮的还原脱卤反应制备。
反应
酮能够参与许多有机反应。其中最主要的一类就是羰基的亲核加成反应以及烯醇对于亲电底物的加成反应。亲核加成反应包括:
与水反应(水解)得到偕二醇。水解平衡在大多数情况下倒向酮一边,不利于偕二醇的生成。
与乙炔化物反应得到α-羟基炔。
与氨或伯胺反应得到亚胺。
与二级胺反应得到烯胺。
与格氏试剂或有机锂试剂反应,然后用水处理后得到三级醇。
与醇或醇盐反应得到半缩酮或其共轭碱。此反应常用来保护酮羰基。
与氨基钠反应,C-C键断裂,得到酰胺RCONH 2 以及烷烃R"H,即Haller-Bauer反应。
亲电加成,与亲电试剂反应得到共振稳定的正离子。
与磷叶立德反应得到烯烃,即著名的Wittig反应。
与硫醇反应得到硫缩酮。
与肼或者1-位取代的肼衍生物反应得到腙。
与金属氢化物反应得到金属烷氧盐,水解后得到醇。即酮的还原。
与卤素反应得到α-卤代酮,反应经烯醇式中间体。参见卤仿反应。
与重水反应得到α-氘代酮。
经Norrish反应光解碎裂化。
1,4-氨基二酮经Robinson-Gabriel合成,脱水得到?唑。
Willgerodt反应中,芳基烷基酮、硫与胺反应,得到酰胺。
与羟胺反应制备肟。
应用
酮在工业中大量用于溶剂、聚合物及医药的生产,其中应用最多的是丙酮、丁酮及环己酮。生物化学中酮类亦是常见的物质。烃类在氧气不足时燃烧,可得酮类及其他各类化合物。
毒性
低级酮毒性大多较低,有些是常用的有机溶剂。某些不饱和酮的毒性较高,如甲基乙烯基酮(LD 507 mg/kg(口服))。
参见
酰基
二酮
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

相关资料

- 有价值
- 一般般
- 没价值








24小时热门
推荐阅读
关于我们

APP下载


























{{item.time}} {{item.replyListShow ? '收起' : '展开'}}评论 {{curReplyId == item.id ? '取消回复' : '回复'}}