气体
元素气体
在标准状况下为气体分子的化学元素有氢(H 2 )、氮(N 2 )、氧(O 2 )和两种卤素,分别是氟(F 2 )和氯(Cl 2 )。另外还有单原子的稀有气体:氦(He)、氖(Ne)、氩(Ar)、氪(Kr)、氙(Xe)和氡(Rn)。
物理性质

烟的颗粒提供了周围气体运动的线索。
因为大多数气体很难直接观察,他们常被通过其四个物理属性或宏观性质来描述:压强、体积、粒子数目(化学家用摩尔来表示)和温度。这四个属性被许多科学家(如罗伯特·波义耳、 雅克·查理 ( 英语 : Jacques Charles ) 、约翰·道尔顿、约瑟夫·路易·盖-吕萨克、阿莫迪欧·阿伏伽德罗等)通过不同的气体和不同的装置来反复观察过。他们的仔细研究最终形成了描述这些属性的数学关系的理想气体定律。
宏观属性
当观察气体时,一般会指明参考物或长度尺度。 较大 的长度尺度对应着气体的宏观属性或是总体看法。其范围(可指体积)至少要能容纳大量的气体粒子。对如此采样尺寸的气体的统计分析会得到样品内所有气体粒子的 平均 属性(例如速度,温度,压强等)。相反,一个较小的参考长度尺度对应着气体的微观属性或是粒子层面的看法。
压力
在公式中常用 "p" 或 "P" 来表示气体压力,其单位则常为国际单位制中的帕斯卡(Pa)。
在描述一个有容器的气体时,压力(或是绝对压力)是在气体作用在容器表面上,单位面积所施的力,在此空间内,可以视为气体粒子会直线运动,直到和其他分子或是容器壁碰撞为止。若和容器壁碰撞,单位时间内气体粒子动量的变化就是气体作用在容器上的力 ,在碰撞过程中,只有垂直容器壁的气体粒子速度分量会变化,若气体粒子是沿着容器壁运动,其动量不会变化。因此容器壁受到的力就是和容器壁碰撞的气体粒子其动量变化的平均值。
压力是所有碰撞容器壁的气体粒子,其产生的力除以容器壁总面积后的值。
温度
"> 播放媒体 空气团在浸入液氮后缩小。
在公式中常用 "T" 来表示气体温度,其单位则常为国际单位制中的开尔文(K)。
气体粒子的速度和其绝对温度成正比。在右边的影片中,当气球放进液态氮中时,因为温度降低,气体粒子速度变慢,气球体积也随之缩小。气体系统的温度和其中粒子(原子或分子)的运动有关 。在统计力学中,温度可以表示储存在粒子中的平均动能。储存能量的方式和粒子的自由度有关。借由气体粒子碰撞,粒子产生平移、旋转或是振动的运动,其动能也随之提高。相反的,固体中的分子因为在晶格中,无法有平移或旋转的运动,只能以振动的方式提高温度。加热的气体,因为持续和容器或其他气体粒子碰撞,其速度分布范围较大,可以用麦克斯韦-玻尔兹曼分布描述,此时会假设气体粒子近似为接近热力学平衡状态下的理想气体。
比容
在公式中常用 "v" 来表示气体比容,其单位则常为国际单位制中的立方米每千克(m /kg)。表示气体体积常用 "V" ,其单位常为立方米(m )。
在描述热力学性质时,会将性质区分内含及外延性质。和气体的量(体积或是质量)有关的量称为外延性质,和气体的量(体积或是质量)无关的量称为内含性质。比容是内含性质,是热平衡时,单位质量气体的体积 。气体的体积和气体量有关,因此是外延性质。
固态和液体的比容会随压力或温度而有轻微的变化,但压力或温度改变时,气体的比容会有显著的变化,温度相同的气体,当压力减半时,其比容会加倍,因此气体具有压缩性。
密度
在公式中常用 ρ 来表示气体密度,其单位则常为国际单位制中的千克每立方米(kg/m ),为比容的倒数。
由于气体分子常会装在容器中移动,其质量一般会用密度来表示。密度是单位体积下的质量,也是比容的倒数。气体密度变化的范围很大.因为当受到压力或体积的限制时,气体分子之间可以靠得更近。密度的变化即为可压缩性,气体的密度和压力及温度都是状态变数,在过程中的变化会依照热力学的定律。针对静态气体而言,气体的密度在整个容器中是相同的。密度是一标量,若是固定质量气体,密度和容器的体积成反比。
微观属性
分子运动论
分子运动论通过考虑气体颗粒的成分和运动来对气体的宏观属性提供一个内在的视角。
布朗运动
气体粒子的随机运动,一开始上方和下方是不同的气体,但最后可以看出气体的扩散
布朗运动是描述流体中粒子随机运动的数学模型。右图动画中粉红色和绿色的粒子说明气体运动的方式。
分子间作用力
当气体被压缩时,分子间作用力开始显示更大的作用。
气体颗粒间短暂的吸引(或排斥)对气体动力学会有影响。在物理化学中,给这类分子间作用力一个名称叫“范德华力”。这种力在决定气体的物理属性(比如粘性和流速)时很重要。在特定条件下(参见分子动力学理论)忽略这种力使得真实气体可以被当作理想气体看待,从而可以使用理想气体定律做简化计算。
模型
理想气体
理想气体 为假想的 气体 。其特性为:
气体分子间无作用力
气体分子本身不占有体积
气体分子与容器器壁间发生完全弹性碰撞
只有在温度高和压力极低的情况下,分子间距离大大增加,分子间作用力趋向于零,实际气体才接近于理想气体。而像He、H 2 、O 2 、N 2 这样的气体,不易液化,在常温常压下的性质也近似于理想气体。
理想气体遵守理想气体状态方程式 :
其中 P 、 V 、 n 和 T 分别是压力、体积、气体摩尔数及绝对温度, R 为理想气体常数,8.314 J/(mol K)。
真实气体在愈低压、愈高温的状态,性质愈接近理想气体。最接近理想气体的气体为氦气。常温常压下的空气也近似理想气体。
真实气体
真实气体一般是指有以下的特性,不能用理想气体简化的气体:
压缩因子Z不为1。
比容会随温度而改变。
非平衡态热力学下的气体。
气体粒子之间的范德华力不能忽略。
气体粒子有离解,或是和其他粒子发生基元反应。
历史成果
气体形态可通过其体积、温度和其压强所影响。这几项要素构成了多项气体定律,而三者之间可以互相影响:
波义耳定律
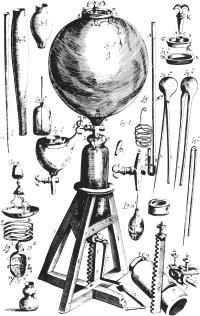
波义耳的实验装置
波义耳定律是指在一定温度下,气体体积增大时,其压强必减小。这可用以下公式表达 :
V = k P {\displaystyle V={\frac {k}{P}}}
这里
V 是指气体的体积
P 指压强
k 为一常数
查理定律
查理定律是指当压力保持固定时,气体体积与其温度成正比。即是气体温度一增加,其体积也随之而增大。其数学表达式为 :
V 1 T 1 = V 2 T 2 {\displaystyle {V_{1} \over T_{1}}={V_{2} \over T_{2}}}
这里
V 是指气体的体积
T 指温度,单位为绝对温标K
盖-吕萨克定律
盖-吕萨克定律是指一固定容器内的理想气体,其压力和温度成正比
这里
P 是指气体的压力
T 指温度,单位为绝对温标K
亚佛加厥定律
亚佛加厥定律是指相同温度及压力的理想气体,其体积和其摩尔数成正比,由此可得气体的摩尔体积,在标准状况下是22.4升。气体体积和摩尔数的关系如下 :
其中n等于气体的摩尔数(总分子数除以亚佛加厥数)
道尔顿分压定律
道耳吞定律是指不会反应的理想气体混合物,其总压力等于各气体分压的和,若有 n 种气体,可以表示为下式 :
特殊主题
可压缩性
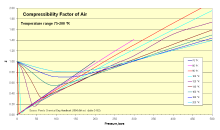
空气的可压缩系数图
热力学家利用可压缩系数( Z )来调整理想气体方程式,考虑真实气体可压缩性的影响。可压缩系数是实际比容和理想比容之间的比例。一般而言其数值很接近1,可压缩系数图描述可压缩系数和温度之间的变化。
雷诺数
在流体机械上,雷诺数是惯性力( v s ρ )和粘滞力( μ/L )之间的比例,是流体力学中最重要的无因次量,常和其他无因次量配合使用来提供动态相似性的准则。雷诺数可以提供模型和全尺寸的实际条件之间的相关性,也常用来作为流体的分类。
黏度
黏度是有关相邻粒子之间影响程度的物理量。固体因为内部的分子间作用力,可以承受剪力,流体在类似的剪力下则会持续的变形,气体的黏度比液体小,不过仍可以观测到黏度的影响,若是气体没有黏度,就不会黏在机翼的表面形成边界层。一个有关三角翼纹影照相的研究可以看出气体分子之间会粘在一起(参照“边界层”一节)。
紊流

在风洞中的三角翼,当气体在机翼前端被压缩时,折射系数变化,产生阴影
紊流是指流场有随机的、混沌的变化,包括少量的动量扩散,大量的动量对流,压力和速度在空间和时间上有快速的变化。
边界层
当气体粒子沿着一物体表面流过时,有些粒子会因物体表面而速度变慢,好像粘在物体表面一样,这称为边界层。主要是因为表面的摩擦力造成。物体和上面的边界层会影响后面的流体,而边界层也会和物体表面分离,形成新的表面,并且改变流体流动的路径。像飞机的失速就是因为边界层分离使得机翼的升力下降。
热力学平衡
当系统中没有能量转移时,此系统已达到热力学平衡。一般而言此时系统和周围的温度相同,因此不会有热的转移。这也表示外力是平衡的,系统体积不会变化,系统中的化学反应也已完成。热力学平衡需要的时间随系统而不同,像冰块在室温下约花几个小时才能融化,在半导体内,一元件由开到关产生的热转移可能只需要数纳秒的时间。
参见
固体→融化→液体→气化→ 气体
固体←凝固←液体←液化← 气体
气体 ←升华←固体←凝华← 气体
参考文献
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

- 有价值
- 一般般
- 没价值



24小时热门
推荐阅读

关于我们

APP下载








































