理想气体状态方程
应用
一定量处于平衡态的气体,其状态与压强、V和T有关,表达这几个量之间的关系的方程称为气体的状态方程,不同的气体有不同的状态方程。但真实气体的方程通常十分复杂,而理想气体的状态方程具有非常简单的形式。
在普通状况,像标准状况,大多数实际气体的物理行为近似于理想气体。在合理容限内,很多种气体,例如氢气、氧气、氮气、惰性气体等等,以及有些较重气体,例如二氧化碳,都可以被视为理想气体。一般而言,在较高温度,较低压强,气体的物理行为比较像理想气体。这是因为,对抗分子间作用力的机械功,与粒子的动能相比,变得较不显著;另外,分子的大小,与分子与分子之间的相隔空间相比,也变得较不显著。
研究过程
在17和18世纪,许多科学家对低压气体经过不断地试验、观察、归纳总结,通过汇集许多双变量的实验定律,推导出了理想气体定律。
玻意耳-马略特定律

波氏的实验示意图
1662年,英国化学家波义耳使用J型玻璃管进行实验:用水银压缩被密封于玻璃管内的空气。加入水银量的不同会使其中空气所受的压力也不同。在实验中,波义耳-经过观察管内空气的体积随水银柱高度不同而发生的变化,记录了如下一组数据:
经过观察,他认为在管粗细均匀的情况下,管中空气的体积与空气柱 l 成正比,而空气所受压力为大气压与水银柱压差Δ h 的和;据此,他认为在恒温下,一定量的空气所受的压力与气体的体积成反比。
其他两位科学家,贝蒂和布里兹曼也研究了氢气的体积和压力的关系,下面是他们的实验数据:
多种气体的试验均得到了相同的结果,这个结果总结为玻意耳-马略特定律,即:温度恒定时,一定量气体的压力和它的体积的乘积为恒量。
数学表达式为: p V = {\displaystyle {pV}=} 恒量(n、T恒定)或 p 1 V 1 = p 2 V 2 {\displaystyle {p_{1}}{V_{1}}={p_{2}}{V_{2}}} ( n 1 = n 2 {\displaystyle {n_{1}}={n_{2}}} 、 T 1 = T 2 {\displaystyle {T_{1}}={T_{2}}} )。
查理定律
查理定律,又称查理-盖-吕萨克定律,是盖-吕萨克在1802年发布,但他参考了 雅克·查理 ( 英语 : Jacques Charles ) 的1787年研究,故后来该定律多称作查理定律。
1787年,查理研究氧气、氮气、氢气、二氧化碳及空气等气体从0℃加热到100℃时的膨胀情况,发现在压力不太大时,任何气体的膨胀速率是一样的,而且是摄氏温度的线性函数。即某一气体在100℃中的体积为 V 100 {\displaystyle {V_{100}}} ,而在0℃时为 V 0 {\displaystyle {V_{0}}} ,经过实验,表明任意气体由0℃升高到100℃,体积增加37% 。数学表达式为:
V 100 − − --> V 0 V 0 = 0.366 = 100 273 {\displaystyle {\frac {V_{100}-V_{0}}{V_{0}}}=0.366={\frac {100}{273}}}
推广到一般情况,若t℃是体积为 V t {\displaystyle {V_{t}}} ,代替 V 100 {\displaystyle {V_{100}}} ,则有:
V t − − --> V 0 V 0 = t 273 {\displaystyle {\frac {V_{t}-V_{0}}{V_{0}}}={\frac {t}{273}}} 或 V t = V 0 ( 1 + t 273 ) {\displaystyle {V_{t}}={V_{0}}\left(1+{\frac {t}{273}}\right)}
即:恒压时,一定量气体每升高1℃,它的体积膨胀了0℃时的 1 273 {\displaystyle {\frac {1}{273}}} 。 当时查理认为是膨胀 1 267 {\displaystyle {\frac {1}{267}}} ,1847年法国化学家雷诺将其修正为 1 273.15 {\displaystyle {\frac {1}{273.15}}} 。
盖吕萨克定律
1802年,盖吕萨克在试验中发现,体积不变时,一定量的气体的压力和温度成正比,即温度每升高(或降低)1℃,其压力也随之增加(或减少)其0℃时压力的 1 273.15 {\displaystyle {\frac {1}{273.15}}} 。
查理-盖吕萨克定律
查理-盖吕萨克定律是近1个世纪后,物理学家克劳修斯和开尔文建立了热力学第二定律,并提出了热力学温标(即绝对温标)的概念,后来,查理-盖吕萨克气体定律被表述为:压力恒定时,一定量气体的体积( V )与其温度( T )成正比。其数学表达式为:
V T = {\displaystyle {\frac {V}{T}}=} 恒量(n为恒量)
或 V 1 T 1 = V 2 T 2 {\displaystyle {\frac {V_{1}}{T_{1}}}={\frac {V_{2}}{T_{2}}}} (n不变)
综合
19世纪中叶,法国科学家克拉珀龙综合玻意耳-马略特定律和查理-盖吕萨克定律,把描述气体状态的3个参数:p、V、T归于一个方程,表述为:一定量气体,体积和压力的乘积与热力学温度成正比。
推导过程如下:设某气体原始状态是 p 1 {\displaystyle p_{1}} 、 V 1 {\displaystyle V_{1}} 、 T 1 {\displaystyle T_{1}} ,最终状态为 p 2 {\displaystyle p_{2}} 、 V 2 {\displaystyle V_{2}} 、 T 2 {\displaystyle T_{2}} ;
首先假定温度 T 1 {\displaystyle T_{1}} 不变,则 p 1 V 1 = p 2 V ′ ′ --> {\displaystyle p_{1}V_{1}=p_{2}V^{\prime }} ;
接着假设压力 p 2 {\displaystyle p_{2}} 不变,则 V ′ ′ --> T 1 = V 2 T 2 {\displaystyle {\frac {V^{\prime }}{T_{1}}}={\frac {V_{2}}{T_{2}}}} 或 V ′ ′ --> = V 2 T 1 T 2 {\displaystyle V^{\prime }=V_{2}{\frac {T_{1}}{T_{2}}}}
将 V ′ ′ --> {\displaystyle V^{\prime }} 带入第一步,得 p 1 V 1 T 1 = p 2 V 2 T 2 = {\displaystyle {\frac {p_{1}V_{1}}{T_{1}}}={\frac {p_{2}V_{2}}{T_{2}}}=} 恒量
在这个方程中,对于1mol的气体,恒量为R,而n(mol)的气体,恒量为nR,R称为摩尔气体常数。
推广
经过Horstmam和门捷列夫等人的支持和提倡,19世纪末,人们开始普遍地使用现行的理想气体状态方程: p V = n R T {\displaystyle pV=nRT}
理想气体常数
理想气体常数(或称摩尔气体常数、普适气体常数)的数值随p和V的单位不同而异,以下是几种常见的表述:
R = p V n T = 8.31 P a ⋅ ⋅ --> m 3 ⋅ ⋅ --> m o l − − --> 1 ⋅ ⋅ --> K − − --> 1 = 0.0831 b a r ⋅ ⋅ --> d m 3 ⋅ ⋅ --> m o l − − --> 1 ⋅ ⋅ --> K − − --> 1 = 0.0821 a t m ⋅ ⋅ --> L ⋅ ⋅ --> m o l − − --> 1 ⋅ ⋅ --> K − − --> 1 = 62.4 m m H g ⋅ ⋅ --> d m 3 ⋅ ⋅ --> m o l − − --> 1 ⋅ ⋅ --> K − − --> 1 = 8.317 J ⋅ ⋅ --> m o l − − --> 1 ⋅ ⋅ --> K − − --> 1 = 1.987 c a l ⋅ ⋅ --> m o l − − --> 1 ⋅ ⋅ --> K − − --> 1 {\displaystyle {\begin{matrix}R={\frac {pV}{nT}}&=&8.31Pa\cdot {m^{3}}\cdot {mol^{-1}}\cdot {K^{-1}}\\\ &=&0.0831bar\cdot {dm^{3}}\cdot {mol^{-1}}\cdot {K^{-1}}\\\ &=&0.0821atm\cdot {L}\cdot {mol^{-1}}\cdot {K^{-1}}\\\ &=&62.4mmHg\cdot {dm^{3}}\cdot {mol^{-1}}\cdot {K^{-1}}\\\ &=&8.317J\cdot {mol^{-1}}\cdot {K^{-1}}\\\ &=&1.987cal\cdot {mol^{-1}}\cdot {K^{-1}}\end{matrix}}}
使用到该方程的定律
阿伏伽德罗定律
阿伏伽德罗定律是阿伏伽德罗假说在19世纪末由气体分子运动论给予理论证明后才成为定律。它被表述为:在相同的温度与相同的压力下,相同体积的气体所含物质的量相同。
通过理想气体方程很容易导出这个定律:若有A、B两种气体,它们的气体方程分别是 p A V A = n A R T A {\displaystyle p_{A}V_{A}=n_{A}RT_{A}} 和 p B V B = n B R T B {\displaystyle p_{B}V_{B}=n_{B}RT_{B}} ,当 p A = p B , T A = T B , V A = V B {\displaystyle p_{A}=p_{B},T_{A}=T_{B},V_{A}=V_{B}} 时,显然 n A = n B {\displaystyle n_{A}=n_{B}} 。这个定律也是理想气体方程的一个例证。
气体分压定律
气体分压定律是1807年由道尔顿首先提出的,因此也叫道尔顿分压定律。这个定律在现代被表述为:在温度与体积恒定时,混合气体的总压力等于组分气体分压力之和,各别气体分压等于该气体占据总气体体积时表现的压强。
使用数学方程表示为
p s u m = ∑ ∑ --> p i {\displaystyle p_{sum}=\sum {p_{i}}} 和 p i = p s u m × × --> n i ∑ ∑ --> n i = p s u m × × --> V i ∑ ∑ --> V i {\displaystyle p_{i}=p_{sum}\times {\frac {n_{i}}{\sum {n_{i}}}}=p_{sum}\times {\frac {V_{i}}{\sum {V_{i}}}}} 。
道尔顿分压定律还可以表现为:气体分压与总压比等于该气体的摩尔数。同样, 单一组分气体在同温同压下,与混合气体总体积之比等于摩尔分数之比,继而等于分压与总压之比。
在恒温、恒体积的条件下,
将 p V = n R T {\displaystyle pV=nRT} 代入 p s u m = ∑ ∑ --> p i {\displaystyle p_{sum}=\sum {p_{i}}} ,
可得 p s u m = ∑ ∑ --> p i = ∑ ∑ --> n i R T V {\displaystyle p_{sum}=\sum {p_{i}}={\frac {\sum {n_{i}}RT}{V}}} ,
易得 p i p s u m = n i ∑ ∑ --> n i = n A n s u m {\displaystyle {\frac {p_{i}}{p_{sum}}}={\frac {n_{i}}{\sum {n_{i}}}}={\frac {n_{A}}{n_{sum}}}} 或 p i = p s u m × × --> n i n s u m {\displaystyle p_{i}=p_{sum}\times {\frac {n_{i}}{n_{sum}}}} 。
当温度与压力相同的条件下,由于 V s u m = ∑ ∑ --> V i {\displaystyle V_{sum}=\sum {V_{i}}} ,代入 p V = n R T {\displaystyle pV=nRT} ,
易得 n i n s u m = n A ∑ ∑ --> n i = V i ∑ ∑ --> V i = V i V s u m {\displaystyle {\frac {n_{i}}{n_{sum}}}={\frac {n_{A}}{\sum {n_{i}}}}={\frac {V_{i}}{\sum {V_{i}}}}={\frac {V_{i}}{V_{sum}}}} ,
代入 p i p s u m = n i ∑ ∑ --> n i = n A n s u m {\displaystyle {\frac {p_{i}}{p_{sum}}}={\frac {n_{i}}{\sum {n_{i}}}}={\frac {n_{A}}{n_{sum}}}} 或 p i = p s u m × × --> n i n s u m {\displaystyle p_{i}=p_{sum}\times {\frac {n_{i}}{n_{sum}}}} ,
可得 p i = p s u m × × --> V i V s u m {\displaystyle p_{i}=p_{sum}\times {\frac {V_{i}}{V_{sum}}}} 或 V i = V s u m × × --> p i p s u m {\displaystyle V_{i}=V_{sum}\times {\frac {p_{i}}{p_{sum}}}} 。
实际气体中的问题
当理想气体状态方程运用于实际气体时会有所偏差,因为理想气体的基本假设在实际气体中并不成立。如实验测定1 mol乙炔在20℃、101kPa时,体积为24.1 dm , p V = 2420 k P a ⋅ ⋅ --> d m 3 {\displaystyle pV=2420kPa\cdot {dm^{3}}} ,而同样在20℃时,在842 kPa下,体积为0.114 dm , p v = 960 k P a ⋅ ⋅ --> d m 3 {\displaystyle pv=960kPa\cdot {dm^{3}}} ,它们相差很多,这是因为,它不是理想气体所致。
一般来说,沸点低的气体在较高的温度和较低的压力时,更接近理想气体,如氧气的沸点为-183℃、氢气沸点为-253℃,它们在常温常压下摩尔体积与理想值仅相差0.1%左右,而二氧化硫的沸点为-10℃,在常温常压下摩尔体积与理想值的相差达到了2.4%。
压缩系数
由于实际气体和理想值之间存在偏差,因此常用压缩系数Z表示实际气体的实验值和理想值之间的偏差,计算Z的方程为: Z = p V n R T {\displaystyle Z={\frac {pV}{nRT}}} 。
当气压很低时,各种气体的性质都接近于理想气体,随压力升高,各种气体偏离理想状态的情况不同,压缩系数Z便会随之改变。
Z受到两个因素的影响:
实际气体分子间的吸引力会使其对器壁碰撞而产生的压力比理想值小,这会使Z减小;
实际气体分子所占用的空间体积使实测体积一定大于理想状态,这会使Z增大。
这两个因素有时会互相抵消,使气体在一定状态下十分接近于理想气体,如二氧化碳在40℃、52 MPa时,Z≈1。
范德瓦耳斯方程
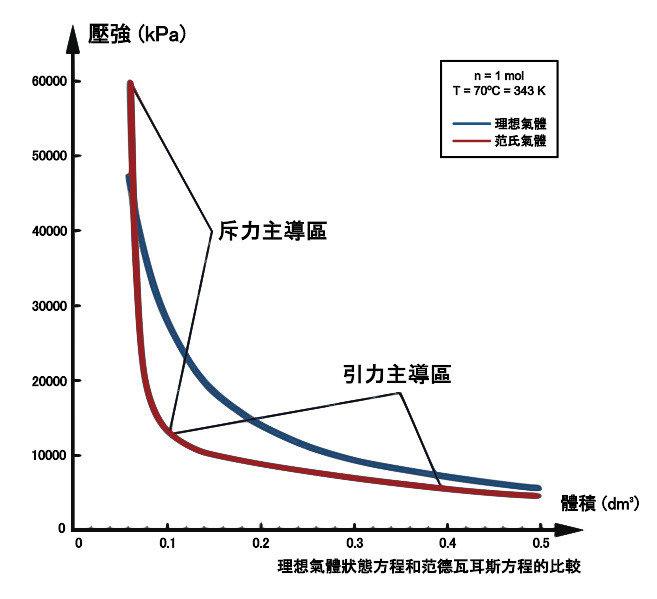
分别用理想气体方程和范德瓦耳斯方程模拟的二氧化碳气体70°C时的p-V等温线
范德瓦耳斯方程是荷兰物理学家约翰内斯·范德瓦耳斯根据以上观点于1873年提出的一种实际气体状态方程,这个方程通常有两种形式:
其具体形式为 ( p + a ′ v 2 ) ( v − − --> b ′ ) = k T {\displaystyle \left(p+{\frac {a"}{v^{2}}}\right)\left(v-b"\right)=kT}
其中与理想气体状态方程不同的几个参数为:
a" 为度量分子间引力的唯象参数
b" 为单个分子本身包含的体积
v 为每个分子平均占有的空间大小(即气体的体积除以总分子数量)
k 为玻尔兹曼常数
而更常用的形式为: ( p + a n 2 V 2 ) ( V − − --> n b ) = n R T {\displaystyle \left(p+a{\frac {n^{2}}{V^{2}}}\right)\left(V-nb\right)=nRT}
其中几个参数为:
V 为总体积
a 为度量分子间引力的参数 a = N A 2 a ′ {\displaystyle a=N_{A}^{2}a"}
b 为1摩尔分子本身包含的体积之和 b = N A b ′ {\displaystyle b=N_{A}b"}
N A {\displaystyle N_{A}} 为阿伏伽德罗常数。
a和b都是常数,叫做范德瓦耳斯常数,其中a用于校正压力,b用于修正体积。
在较低的压力情况下,理想气体状态方程是范德瓦耳斯方程的一个良好近似。而随着气体压力的增加,范德瓦耳斯方程和理想气体方程结果的差别会变得十分明显。
范德瓦耳斯方程对气-液临界温度以上流体性质的描写优于理想气体方程。对温度稍低于临界温度的液体和低压气体也有较合理的描述。
但是,当描述对象处于状态参量空间(P,V,T)中气液相变区(即正在发生气液转变)时,对于固定的温度,气相的压强恒为所在温度下的饱和蒸气压,即不再随体积V(严格地说应该是单位质量气体占用的体积,即比容)变化而变化,所以这种情况下范德瓦耳斯方程不再适用。
理想气体状态方程和范式方程的重大区别在于,理想气体状态方程本身不能预言相变的发生,因为其一级相变点 ∂ ∂ --> p / ∂ ∂ --> V = 0 {\displaystyle \partial p/\partial V=0} 是无解的,而范式方程则存在相变点。
参见
热力学
气体化合体积定律
气体扩散定律
气体分子运动论
完全气体
注释
^ 几个参数为: p 为理想气体的压强,单位通常为atm或kPa; V 为理想气体的体积,单位为L或称dm 3; n 为理想气体中气体物质的量,单位为mol; R 为摩尔气体常数,约为 0.082 a t m ⋅ ⋅ --> L ⋅ ⋅ --> m o l − − --> 1 ⋅ ⋅ --> K − − --> 1 {\displaystyle 0.082{atm}\cdot {L}\cdot {mol}^{-1}\cdot {K}^{-1}} 或 8.314472 k P a ⋅ ⋅ --> d m 3 ⋅ ⋅ --> m o l − − --> 1 ⋅ ⋅ --> K − − --> 1 {\displaystyle 8.314472{kPa}\cdot {dm}^{3}\cdot {mol}^{-1}\cdot {K}^{温度}} ,更多值参见理想气体常数; T 为理想气体的温度,单位为K
^ 其实查理早就发现压强与温度的关系,只是当时未发表,也未被人注意。直到盖吕萨克从新提出后,才受到重视。早年都称“查理定律”,但为表彰盖-吕萨克的贡献而称为“查理-盖吕萨克定律”。
参考文献
一般参考
厦门大学化学化工学院物化教研室.气体的pVT方程 (PDF) . 2005年7月17日: 6–8 [ 2009-02-11 ] (中文()) .
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

- 有价值
- 一般般
- 没价值








24小时热门
推荐阅读
知识互答
关于我们

APP下载


























{{item.time}} {{item.replyListShow ? '收起' : '展开'}}评论 {{curReplyId == item.id ? '取消回复' : '回复'}}