帕金森病
分类
帕金森综合征 ( 英语 : parkinsonism ) (parkinsonism)是一种运动综合征,主要症状有静止性颤抖、肢体僵硬、运动迟缓和姿态不稳,并可根据成因分为以下四型:
原发性或 自发性 ( 英语 : idiopathic )
次级或后天获得
遗传性
帕金森附加综合征 ( 英语 : Parkinson plus syndrome ) 或多重系统退化
帕金森病(Parkinson"s disease)则是指原发性的帕金森综合征,意即它没有其余三者明确可识别的成因,同时也是最常见的一种帕金森综合征。近年来发现数个基因与帕金森病有直接关联,这与原先以自发性疾病为准的定义产生冲突,因此一般也将和帕金森病病程类似的遗传性帕金森综合征纳入帕金森病,并用“家族性帕金森病”和“偶发性帕金森病”来区别遗传性和真正病因不明的帕金森综合征。
帕金森病通常归类为 运动性疾病( 英语 : movement disorder ),但它也会引起其他非运动性的症状,例如感觉障碍、认知困难和睡眠障碍。帕金森附加综合征则是在原发性帕金森病的基础外还有其他附加症状 ,包括 多重系统退化 ( 英语 : multiple system atrophy ) 、 进行性上眼神经核麻痹 ( 英语 : progressive supranuclear palsy ) 、 大脑皮质基底核退化 ( 英语 : corticobasal degeneration ) 和路易氏体型失智 。
就病理生理学而言,由于 α-突触核蛋白 ( 英语 : alpha-synuclein ) 以 路易氏体 ( 英语 : Lewy body ) 的形式堆积,帕金森病被视为一种 突触核蛋白病变 ( 英语 : synucleiopathy ) ,这和阿兹海默病当中Tau蛋白堆积形成的 神经纤维纠缠 ( 英语 : neurofibrillary tangle ) 截然不同 。然而,突触核蛋白病和 Tau蛋白病 ( 英语 : tauopathy ) 在临床上有重叠的地方,严重的帕金森病患者往往也会出现典型的阿兹海默病症状(失智),他们的脑内也常会发现神经纤维纠缠。
路易氏体型痴呆症是另一种与帕金森病类似的突触核蛋白病变,这样的相似性在伴随有痴呆症的帕金森病患者身上更为明显,然而这两种疾病之间的关系目前仍有待进一步研究厘清。它们可能视同两种分别的疾病,也可能视为一种疾病在不同面向的展现 。
症状

帕金森病患者曲姿走路的照片,摄于1892年。
一名帕金森病患者写的手稿。
帕金森病使患者产生运动症状和非运动症状,后者包括自主神经系统功能异常、神经精神 ( 英语 : neuropsychiatry )疾患(包括情绪、认知、行为和思想改变)、感觉和睡眠障碍等。一些非运动症状常在诊断时就已经出现,甚至可能比运动症状更早发生。
运动症状
帕金森病有四种主要( 英语 : Cardinal sign (pathology) )运动症状:颤抖、肢体僵硬、动作迟缓、姿态不稳。
颤抖是最明显且最为人所知的症状,大约有30%的帕金森病病患在疾病刚开始时不会颤抖,但随着病程进展,多数病患会逐渐产生此症状。帕金森病的颤抖通常是静止性颤抖,也就是四肢在静止状态时抖动最明显,但睡觉或有意识地移动四肢时症状却会消失。颤抖对四肢远端的影响较大,刚发病时通常只有一只手或一只脚有症状,但随后会扩及双手和双脚。帕金森病的颤抖频率介于4-6赫兹,常伴随有“搓药丸”的手部动作,也就是患者食指会不自主地向大拇指靠拢,使两指相互绕圈圈,就好像药师在做药丸一般 。
运动功能减退症(hypokinesia)是帕金森病的另一个特征,患者动作变慢,且会影响从运动起始到执行的整个过程。患者无法做出连续动作或同步执行不同动作。运动迟缓症(bradykinesia)属于运动功能减退症的一种,强调运动执行过程的动作缓慢,是帕金森病早期常见的症状。患者最初会在执行日常生活的精细动作(如写字、缝纫或梳妆)时遇到困难;临床评估则是令患者做出类似上述的动作来观察 。运动迟缓症造成的影响随动作种类和患者身心状态而异,影响程度受到患者活动力和情绪状态的影响,导致有些患者严重到无法走路,但有些患者却还能骑自行车 。一般而言,帕金森病患者在治疗后能改善运动迟缓的症状。
肢体僵硬(rigidity)是由于患者肌张力增加,肌肉持续收缩,导致四肢移动困难。帕金森综合征造成的肢体僵硬可能是铅管型僵硬(阻力固定)或齿轮型僵硬(阻力不固定但具规则性),齿轮型僵硬可能是颤抖结合肌张力增加造成的。肢体僵硬也可能和关节痛有关,患者初期常会有此种症状。帕金森病早期患者的肢体僵硬常是不对称的,且好发于颈部和肩膀,随后扩及颜面和四肢,最后随病程进展蔓延到全身,使患者逐渐失去运动能 。
姿态不稳( 英语 : Postural instability )(postural instability)是帕金森病晚期的典型症状,患者因 丧失平衡感 ( 英语 : Balance disorder ) 而经常跌倒,并常因此骨折。疾病初期通常不会有姿态不稳的现象,年轻患者尤其如此 。高达40%的患者曾因姿态不稳跌倒,10%更是每周都跌倒至少一次,跌倒的次数和病情严重程度有关 。
帕金森病其他的运动征象还包括姿态、说话与吞咽异常。患者为避免跌倒可能会产生 慌张步态( 英语 : Parkinsonian gait )(走路时加速步伐且姿体前屈( 英语 : camptocormia ) ) ;他们也可能发声困难( 英语 : dysphonia ) 、面具脸 ( 英语 : hypomimia ) 或 写字越来越小( 英语 : micrographia (handwriting) ) ,患者可能产生各种运动问题。
神经性精神疾患
帕金森病可能导致轻度到重度的神经性精神疾患( 英语 : Neuropsychiatry ),包括言语、认知、情绪、行为和思考混乱。
疾病早期就可能有认知混乱的现象,有时候甚至在诊断出帕金森病前就会有此类症状,且盛行率随得病时间增加。帕金森病患者最常见的认知缺陷问题为 执行困难( 英语 : executive dysfunction ),这将使患者在计划 认知弹性( 英语 : cognitive flexibility )、抽象思考、规则理解、做出适当行为、工作记忆、专注力等方面都受到影响 ;其他认知困难症状还包括注意力涣散、时间感受和估计不准确、认知处理缓慢 ( 英语 : bradyphrenia )等问题。患者的记忆力会受到影响,尤其难以回忆先前学习的讯息;然而,若提供线索辅助患者回忆则能改善相关的症状。失去空间感是另一种可能的症状,检验中会要求患者辨识脸部表情和画线的方向来判断患者是否有此类障碍。
帕金森病患者失智的风险约为一般人的2-6倍,且发生率随得病时间增加。痴呆症使患者和照护者的生活品质降低,同时使患者死亡率增高,并有更大的机会需要住进疗养院。
相较于一般人,没有认知障碍的帕金森病患者较容易有行为和情绪障碍,且这些患者通常没有痴呆症。最常见的情绪障碍有忧郁、冷漠和焦虑。然而,帕金森病患者常会有痴呆症、脸部表情减少、运动功能减退、冷漠和发声困难( 英语 : hypophonia ) 等症状,这使得要诊断出情绪障碍变得更加复杂。帕金森病患者也可能会有 药物滥用和成瘾( 英语 : Dopamine dysregulation syndrome )、狂食症( 英语 : binge eating )、亢进或赌博成瘾等 冲动控制 ( 英语 : Impulse control disorders )行为,这些行为可能和治疗使用的药物有关。约4%的帕金森病病患有幻觉或妄想等思觉失调症状,一般认为这些精神症状是治疗过程中多巴胺过量造成的结果,因此得病越久或服用越多L-多巴的患者也越容易有这些症状。
其他症状
睡眠障碍也是一种可能的帕金森病症状,治疗用的药物可能会恶化相关问题。患者会有嗜睡、快速动眼期中断、失眠等现象,一份系统性回顾报告显示13.0%服用多巴胺药物的帕金森病患者都有睡眠问题。
自主神经系统的改变可能会导致姿势性低血压、油性皮肤、多汗、尿失禁和性功能障碍 。患者也可能会严重便秘和肠胃蠕动异常( 英语 : intestinal pseudoobstruction ) ,造成患者极度不舒服并危害健康。帕金森病也和部分眼疾和视力异常有关,包括眨眼频率降低、干眼症、追视( 英语 : smooth pursuit )障碍、跳视( 英语 : Saccade )(双眼受自主神经影响而往同方向跳动)、无法向上凝视、视力模糊( 英语 : Blurred vision )和复视。感官问题则可能表现在失去嗅觉、失去痛觉和感觉异常 ( 英语 : paresthesia )(皮肤刺痛和麻木)。上述所有自主神经和感官症状在确诊前一年就可能发生。
病因
多数帕金森病患者病因不明( 英语 : idiopathic ),只有小部分可归因于遗传因素 。其他风险因子也可能和帕金森病有关,但因果关系还未证实。
环境因子

越战期间,美军直升机在越南农地上空喷洒橙剂。
一些环境因子可能会造成罹患帕金森病的风险增加,包括农药、头部创伤、务农或生活在乡间 。郊外的环境和饮用水较有可能暴露于杀虫剂,因此间接影响人们的罹病风险。
和帕金森病相关的物质包括杀虫剂、毒死蜱、有机氯化物 、农药(如鱼藤酮和百草枯)和除草剂(如橙剂和 福美锌 ( 英语 : ziram ) )。由于重金属可能会累积在中脑黑质,因此也存疑为风险因子,但目前研究并无定论 。
遗传因子
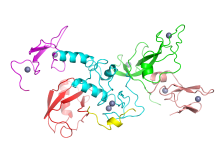
帕金蛋白晶体的结构
传统上认为帕金森病不是遗传性疾病,但15%的病患都有一级亲属(包括父母、子女和手足)以内的亲属罹患帕金森病。已知至少5%的帕金森病是由一或数个特定基因突变造成。
目前已证实特定的基因突变会造成帕金森病,这些基因编码的蛋白质包括 α-突触核蛋白( 英语 : alpha-synuclein ) (SNCA)、 帕金蛋白 ( 英语 : Parkin (ligase) ) (PRKN)、PARK8( LRRK2 ( 英语 : LRRK2 ) ,又称震颤素)、PTEN诱导激酶( PINK1 ( 英语 : PINK1 ) )、 DJ-1 ( 英语 : PARK7 ) 和 ATP13A2 ( 英语 : ATP13A2 ) 。除了LRRK2之外,拥有这些突变的人通常都会罹患帕金森病;而LRRK2突变只会造成小部分人得病 。SNCA和LRRK2是目前研究最深入的帕金森病相关基因,SNCA、LRRK2和葡糖脑苷脂(GBA)突变会增加罹患偶发性帕金森病的风险;GBA突变则会造成高雪氏症。研究人员利用全基因组关联分析搜索偶发性帕金森病中外显率很低的突变等位基因,目前已经获得了许多正面结果。
由于α-突触核蛋白是路易氏体( 英语 : Lewy body )的成分,因此SNCA基因对帕金森病很重要。家族性帕金森病患者的SCNA基因可能发生错义突变(单核苷酸改变造成氨基酸改变)、二重复或三重复 ;错意突变很少见;但约有2%的家族性帕金森病病患是基因重复造成的。一些帕金森病带原者身上也能发现SNCA基因突变,但由于外显度不足或年龄未到而未发病。
LRRK2基因编码的蛋白质称为震颤素( 英语 : dardarin ),由于这个基因最先在英格兰和北西班牙的家族中发现,因此其英文名称“dardarin”来自巴斯克语的“颤抖” 。LRRK2基因突变是偶发性帕金森病最常见的已知成因,占了有家族遗传史患者的5%和偶发性患者的3%,其突变的类型很多,但目前只有少数证实会致病。
部分帕金森病相关基因参与溶体的消化功能,因此有研究推测帕金森病可能和溶体失能有关,这将使细胞无法分解α-突触核蛋白。
病理学
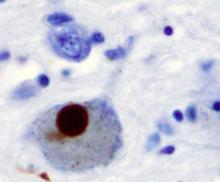
帕金森病患者大脑黑质中的 路易氏体 ( 英语 : Lewy body ) (褐色构造)。本样本对 α-突触核蛋白 ( 英语 : alpha-synuclein ) 进行免疫组织染色。
解剖学
帕金森病的主要病理变化发生在中脑黑质腹侧的致密部( 英语 : pars compacta )。该区含有大量多巴胺神经元,并传讯给大脑基底核。本疾病的患者致密部神经元大量死亡,有的甚至丧失高达70%的神经元。
一般来说,正常人的蓝斑核及黑质颜色较深,因为该区的细胞会产生神经黑色素( 英语 : neuromelanin )。而帕金森病患者的蓝斑核及黑质会因神经元大量死亡而显得较淡。微观病例变化( 英语:histopathology )则可观察到黑质的神经元数量减少,并在残余细胞中存有路易氏体( 英语 : Lewy body );同时,星状细胞会伴随着神经元一起死亡,微胶细胞( 英语 : microglia )则会活化以清除细胞残骸。其中路易氏体为帕金森病最具鉴别性的病理特征。
病理生理学
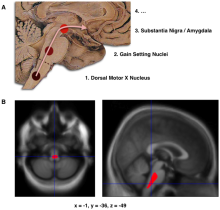
A:此示意图说明帕金森病早期路易氏体堆积的进程。病程发展依序为:1.背侧X运动神经核;2.运动设置神经核;3.黑质/杏仁核。 B:图中的定位点显示出早期帕金森病患者脑部 体积明显减少 ( 英语 : Voxel-based morphometry ) ,该份研究比较帕金森病患者和非患者的神经学影像,归纳出脑干损伤可能是帕金森病最早能诊断出的神经病变。
帕金森病的主要症状大多肇因于黑质致密部( 英语 : pars compacta ) 的多巴胺性神经元退化。
大脑基底核与外界联系的路径大致依其投射位置可分为五条,分别为动作回路( 英语 : Motor cortex )、动眼回路( 英语 : Frontal eye fields )、联合皮质回路、边缘系统回路和眼眶额叶皮质回路 ( 英语 : orbitofrontal )。由于帕金森病会影响基底核上游信息的传递,因此前述的所有回路都会受到波及,使得帕金森病患者会出现动作、注意力和学习上的障碍。目前该疾病对运动回路的影响研究得最为透澈。
1980年,运动回路的理论雏形以及该回路与帕金森病的关联性提出,对当时的科学界带来极大的影响。虽然事后发现该模型无法解释某些现象,因此做了一些修正。在这个模型中,基底核负责抑制运动系统,以避免其于不适当的时机活化。当大脑确定要做某个动作时,基底核会减少 抑制信号 ( 英语 : Inhibitory postsynaptic potential ),使动作能顺利执行。而多巴胺可以抑制来自基底核的抑制信息,因此多巴胺浓度高时能促使运动指令顺利发生,多巴胺浓度低时运动指令就会受到基底核的抑制。帕金森病患者的中枢神经多巴胺浓度较低,因而造成运动功能减退。基于此种理论,药物治疗上常会选用提升多巴胺浓度的药品,但这样的结果也常导致运动系统在不恰当的时机活化,造成身体产生 不自主的运动( 英语 : dyskinesia )。
脑神经元死亡
帕金森病造成多巴胺神经元死亡的原因目前仍未有定论。有理论认为是因为患者的 α-突触核蛋白( 英语 : alpha-synuclein )累积,并与泛素结合,导致细胞破坏,这些不易溶的蛋白质便沉积于细胞体内,形成路易氏体 ( 英语 : Lewy bodies )。根据布拉克分期( 英语 : Braak staging ),路易氏体会先出现于嗅球、延髓和桥脑被盖区( 英语 : pontine tegmentum ),此阶段的患者尚未有明显症状。随着疾病进展,路易氏体会出现于中脑黑质区以及前脑基部,最后出现于新皮质,这也是患者主要受创的脑区。然而,也有人认为路易氏体未必会导致细胞死亡,甚至有可能是一种保护性的蛋白质。路易氏体也普遍存在痴呆症患者的大脑皮质,但神经纤维纠缠( 英语 :Neurofibrillary tangles ) 和 老年斑 ( 英语 : senile plaque )等阿兹海默症的特色只会在失智的患者现。
蛋白酶体失能、溶体失能以及线粒体活性降低也是造成细胞死亡的机制。中脑黑质细胞的离子堆积常伴随蛋白质包涵体一起出现,这可能和氧化压力、蛋白质凝集( 英语 : protein aggregation )和神经细胞死亡有关,但确切机制仍未明了。
诊断
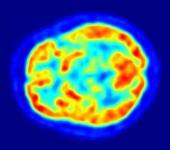
健康脑部的氟代脱氧葡萄糖( F,FDG)正子断层扫描。热区表示葡萄糖摄取量较高,基底核的状况能帮助诊断帕金森病。
帕金森病的诊断仰赖病史和神经学检查( 英语 : neurological examination ),目前没有检验方法能有效确认帕金森病,但脑部造影有时能排除其他症状相似的疾病。患者服用L-多巴后运动症状的改善能帮助医师确认病患罹患的确实是帕金森病。验尸时若能在中脑找到路易氏体(英语 : Lewy body ),则能证明该患者生前罹患帕金森病。随着病程进展,有时疾病自然会出现不是帕金森病的症状,医师便能排除帕金森病的可能,因此一些权威指引建议医师必须定期重新检视帕金森病病患的诊断结果。
其他一些疾病可能会间接造成帕金森综合征,包括阿兹海默症、多重大脑梗塞 ( 英语 : cerebral infarction ) 和药物诱导。帕金森附加综合征 ( 英语 : Parkinson plus syndrome )(如 进行性上眼神经核麻痹 ( 英语 : progressive supranuclear palsy )和多重系统退化( 英语 : multiple system atrophy ) )则必须透过鉴别诊断排除。抗帕金森药物对帕金森附加综合征通常较无效 ,若患者有病程较快、早期认知困难、姿态不稳、轻度颤抖或两侧同时产生症状,代表他可能罹患帕金森附加综合征,而非单纯的帕金森病。遗传性的帕金森综合征通常会归类为帕金森病,但家族性帕金森病和家族性帕金森综合征这两个词汇都能用来表示此类疾患。
医学机构订定了帕金森病的诊断条件,以将此流程简化和标准化,这在疾病早期尤其有用。其中最广为人知的为英国帕金森病协会( 英语 : Parkinson"s UK )的大脑银行和和美国国家神经疾病及中风研究中心( 英语 : National Institute of Neurological Disorders and Stroke )。大脑银行定义动作迟缓为帕金森病患者的诊断要件,且同时要有肢体僵硬、静止性颤抖或姿态不稳中至少其中一种症状,并排除其他疾病的可能;随着病程进展,患者的症状还必须有下列特色:包括由单侧发作、静止性颤抖、疾病随时间进展、运动症状不对称、至少五年内对L-多巴治疗有反应、临床病程至少十年、服用过多L-多巴后会造成运动困难等。根据病理解剖的评估,上述诊断条件的准确性约75-90%,神经内科医师等专家做出的诊断则有更高的准确率。
帕金森病患者脑部的计算机断层成像(CT)和核磁共振成像(MRI)常看起来与正常者无异,但这些技术能用来排除其他可能造成帕金森综合征的间接原因,例如基底核肿瘤、血管病变和脑水肿。有报告指出扩散磁振造影(一种核磁共振成像技术)有助于辨别典型和非典型帕金森综合征,但其确切的诊断力仍在研究中。基底核的多巴胺功能可以透过正子发射计算机断层成像(PET)和单光子发射计算机断层成像( 英语 : Single photon emission computed tomography )(SPECT)等放射显影技术量测,例如SPECT所使用的 碘氟潘(碘-123)( 英语 : ioflupane (123I) )(商品名DaTSCAN)和 碘苯托烷 ( 英语 : RTI-55 )(Dopascan),以及PET所使用的氟代脱氧葡萄糖 和 DTBZ ( 英语 : DTBZ )。基底核的多巴胺活性降低也能协助诊断帕金森病。
预防
中年人运动有助于减少往后得到帕金森病的风险。喝较多咖啡因饮料的人得病风险明显较低,咖啡因似乎在其中扮演保护性的作用。虽然吸烟会造成负面的健康效应、降低寿命和生活品质,但或许能减少罹患帕金森病的风险,其中的机制还不明了,但可能和尼古丁刺激多巴胺的功能有关;另外烟中也含有一些能作为单胺氧化酶抑制剂(MAO)的化合物,这或许也是造成此种效应的原因。
维生素C、D等抗氧化剂被认为能保护脑细胞免于罹患帕金森病,但研究并没有得到正面的结论。脂肪和脂肪酸相关的研究同样也缺乏一致的结论,有些研究显示它们有保护性作用、能减少罹病风险;但有些显示没有效果。此外,目前研究初步显示雌激素和非甾体抗炎药也可能有保护性作用。
治疗
目前尚未发展出能完全治愈帕金森病的方法,但有一些药物、手术和跨领域整合治疗能缓解症状。治疗运动症状的药物包含L-多巴、多巴胺受体激动剂( 英语 : dopamine agonist )和单胺氧化酶抑制剂等。至于要选用哪一种药物,则须视疾病的状态而定。一般而言,症状初期会使用前述的后两类药物进行治疗,以避免L-多巴相关的副作用 。到了症状后期症状较强时,才会开始使用L-多巴。此时期需注意剂量波动对于患者的伤害,增减剂量需在医师处方下才能执行。当药物治疗已无法控制症状时,则可以考虑使用脑深层刺激手术。到疾病末期,则建议进入安宁疗护,以维持病患的生活品质。
L-多巴
L-多巴(Levodopa)是近30年使用最为广泛的药物。本品会于多巴胺性神经元中,透过芳香族L-氨基酸脱羧酶转化为多巴胺,借此暂时缓解疾病的运动症状 。
然而,大约只有5-10%的L-多巴会穿透血脑障蔽,残余的药物则会代谢为多巴胺,造成包含恶心、异动症( 英语 : dyskinesia )和关节僵硬等副作用。因此本品一般会与 卡比多( 英语 :Carbidopa )(carbidopa)或芐丝肼( 英语 : benserazide ) (benserazide)等多巴脱羧酶抑制剂( 英语 : dopa decarboxylase inhibitor )药物合并使用,以抑制周边组织产生多巴胺,达到提升生物利用度及减少副作用的效果。现有药厂生产复方药剂将卡比多巴和L-多巴(co-careldopa)或芐丝肼和L-多巴( 英语: benserazide )制成复方药剂。L-多巴具成瘾性,可能造成某些特有的 重复行为 ( 英语 : punding ),此类药物性症状称为多巴胺失调综合征( 英语 : dopamine dysregulation syndrome )。
L-多巴在体内容易由儿茶酚-O-甲基转移酶(COMT)降解,因此本品可与COMT抑制剂托卡朋( 英语 : Tolcapone )(tolcapone)合并使用以维持药效。然而COMT抑制剂具有肝毒性,因此在使用上必须注意,另也可选用肝毒性较小的恩他卡朋(entacapone)替代。目前核准的药物有托卡朋或恩他卡朋的单品,也有含L-多巴及卡比多巴的复方药剂。
另外,用药时的剂量波动会对患者生活造成严重影响 。患者刚用药时,体内剂量较高,因此患者的症状较和缓,此时称为“通电状态”("on" state);反之,在药效降低后,患者的运动性症状又会出现,此时称为“断电状态”("off" state)。过高剂量的L-多巴会使患者产生异动症( 英语 : dyskinesia ),无限制地提高药物剂量并非将药物浓度控制于“通电状态”的方法。因此须以其他方法延长药物在体内滞留的时间,方法包含合并使用多巴胺受体激动剂及MAO-B受体抑制剂。以往医师会借由暂时停用L-多巴以减少运动性症状,但该作法可能导致抗精神病药物恶性综合征( 英语 : neuroleptic malignant syndrome )等致命性的副作用,所以现在已不再使用。目前有厂商发展出静脉内及肠道内的缓释技术( 英语 : Slow-release ),让L-多巴稳定缓慢释放。研究显示缓释剂比起传统剂型能有效减少异动症的情形。大多数患者终身必须服用L-多巴,且一般日后皆会遇到本品的运动性副作用。
多巴胺受体激动剂
除了L-多巴之外,还有数种多巴胺受体激动剂( 英语 : dopamine agonist )也能与突触后的多巴胺受体结合,借此达到治疗的效果。此类药品最初应用于改善患者使用L-多巴后的副作用,现在则大多用于延缓初期运动性症状的治疗 ,症状后期使用本品则能改善“断电状态”("off" state)的症状。属于多巴胺受体激动剂的药物包含溴隐亭(bromocriptine)、培高利特( 英语 : pergolide )(pergolide)、普拉克索( 英语 : pramipexole ) (pramipexole)、力必平( 英语 :ropinirole ) (ropinirole)、 过乳降 ( 英语 : cabergoline )(cabergoline)、阿朴吗啡( 英语 : arphine )(arphine)和麦角乙脲( 英语 : lisuride ) (lisuride)。
多巴胺受体激动剂可能造成或重或轻的副作用,包含昏睡、幻觉、失眠、恶心和便秘等 。有些患者即使剂量极轻也会产生副作用,此时建议医生考虑更换药品。多巴胺受体激动剂可以延缓运动性症状的产生,虽药效不如L-多巴那样强,但足以控制初期症状 。此类药物价格一般较L-多巴为高。年轻患者服用本类药物通常较少产生异动症,副作用会随年龄越大而增加。本类药物通常用于治疗初期症状,以延缓L-多巴的使用 。它产生的冲动控制障碍较L-多巴强,患者可能会出现病态性的暴食、性冲动、赌博和购物等现象。
阿朴吗啡( 英语 : Arphine )(arphine)可用于减缓病程晚期的断电状态症状及异动症现象,能选用的给药途径包括间歇性注射和皮下持续输注(英语 :subcutaneous infusion )。由于意识混乱和幻觉等副作用相当常见,接受阿朴吗啡治疗的病患状况必须严密监控。麦角乙脲( 英语 : lisuride )(lisuride)和罗替戈汀( 英语 : rotigotine )(rotigotine)是两种借由皮肤贴片给药的多巴胺激动剂,它们不仅对早期患者很有用,也可能可以控制严重患者断电状态下的病情。
单胺氧化酶抑制剂
单胺氧化酶抑制剂包括有沙芬酰胺( 英语 : safinamide )(safinamide)、希利治林( 英语 : selegiline )(selegiline)和雷沙吉兰(rasagiline),此类药品能借由抑制单胺氧化酶B(英语:monoamine oxidase B )(MAO-B)增加基底核的多巴胺含量,多巴胺神经元分泌的MAO-B会降解多巴胺,因此MAO-B活性降低将能使纹状体( 英语 : striatum )(基底核的一部分)L-多巴含量增加。就如同多巴胺受体激动剂一样,单用单胺氧化酶抑制剂治疗患者能改善运动症状,并延迟早期患者需要服用L-多巴的时间,但它比多巴胺受体激动剂有更多副作用,且效果也不如L-多巴。虽然有研究指出单胺氧化酶抑制剂能减少严重患者的病情在“断电”("off" state)和“通电”("on" state)状态之间波动,但针对较晚期患者的单胺氧化酶抑制剂研究却不多。目前一项初步结果显示希利治林和L-多巴复方可能会导致死亡率增加,但还有待进一步证实。
其他药物
其他药物如金刚烷胺(amantadine)和抗胆碱剂(anticholinergics)在治疗运动症状方面可能有用,然而相关的研究证据品质不佳,因此不是治疗的首选。除了运动症状之外,帕金森病也常伴随多样的症状,许多药物因此用来解决这些问题,例如喹硫平(quetiapine)用来治疗精神疾患; 胆碱酯酶抑制剂 ( 英语 : cholinesterase inhibitors )能治疗失智;莫达非尼(modafinil)则用来治疗日间嗜睡 ( 英语 : excessive daytime sleepiness )。2010的一项后设分析研究发现非类固醇消炎止痛药(除了阿司匹林)使用者的帕金森病发生率比一般人少15%,长期使用者降低的比率更多。
手术
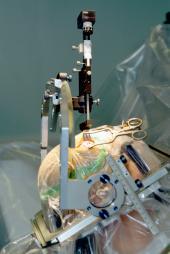
图为置入脑中的微电极,患者头部进行固定以实施 立体定位手术( 英语 : stereotactic surgery ) 。
使用手术治疗运动症状一度很常见,但自从L-多巴发现后,执行手术的患者大幅减少。过去数十年来的研究使外科技术进步良多,于是较严重且药物治疗无效的患者又重新将手术列入考量 。帕金森病患者进行的手术可分为两大类:烧灼术和脑深层刺激手术(DBS),手术的目标包括视丘、 苍白球 ( 英语 : globus pallidus ) 或 视丘下核 ( 英语 : subthalamic nucleus )。脑深层刺激手术于1980年代由 阿里姆·路易斯·本纳比( 英语 : Alim-Louis Benabid ) (Alim-Louis Benabid)等人发展出来,是目前最常使用的手术治疗方式,手术将一个神经刺激器( 英语 : neurostimulator )置入脑中,刺激器再以电冲动刺激特定脑区。一般会推荐运动症状时好时坏而呈反复波动的病人进行脑深层刺激手术,对于药物控制不佳或无法接受药物的颤抖病人也很适合,只要他们没有严重的精神问题 。另一种较少见的手术方式是破坏特定的区域以压制皮质下区的过度表现,例如苍白球切除术( 英语 : pallidotomy ) 就是将苍白球破坏以舒缓运动困难。
复健
医师通常会建议帕金森病患者执行运动计划,部分证据指出说话或运动问题能透过复健改善,虽然这方面的研究不多且品质不齐。规律的体能锻炼有益于患者维持或改善运动能力、灵活度、力气、行走速度和生活品质,体能锻炼也可以搭配物理治疗进行 。有证据显示在物理治疗师的指导下,患者的运动症状、情绪知能、日常活动和生活品质能比自行在家训练者有更显著的改善。对想改善动作灵活度的肢体僵硬患者来说,一般的放松技巧(如轻微摆动肢体)就能减少肌肉过度紧张,其他促进肌肉放松的技巧还包括缓慢的旋转四肢或躯干、节律启动、腹式呼吸( 英语 : diaphragmatic breathing )和冥想。至于如运动减缓、曳步、走路时手不摆动等步姿问题则有多种策略能改善患者的运动功能和安全性,此类的复健计划着重但不限于改善患者的步型速度、下肢支撑、跨步距离和肢体摆动,具体策略包括使用辅助器材(如北欧式健走或踏步机训练)、口语(手法、听觉或视觉)引导、运动(踏步或 PNF伸展 ( 英语 : PNF stretching ))和环境改造。伸展运动有助于改善原发性肌无力以及轻中度帕金森病患者的动作和力量。报告显示,患者的肌力和服药时间有明显的相关性。因此,帕金森病患者应在服药后45分钟至一个小时左右身体状态最好的时候运动 。此外,由于较严重的帕金森氏患者躯体前弯且呼吸系统失能,腹式深呼吸运动有助于强化胸腔壁的运动能力和肺活量。运动也有助于改善便秘问题。
在言语治疗方面,最常用的方法之一为李·西弗曼语音治疗( 英语 : Lee Silverman voice treatment )(LVST),此类治疗对于患者的口语表达有所帮助。职能治疗方面则是以改善患者健康及生活品质为目标,协助患者恢复最大量的日常生活活动。虽然有文献指出职能治疗可以改善运动技巧,并有助于提升患者在治疗期间的生活品质,但有关职能治疗对于帕金森病患者的效果研究很少,且品质大多不佳。
缓和医疗
缓和医疗是给严重疾病患者的特殊医疗照护,当中也包括了帕金森病。缓和医疗以提升患者和其家属的生活品质为目的,透过各种方式让患者能免于疾病所带来的症状、痛苦和压力。由于帕金森病无法治愈,所有医疗行为的目标都是要减缓病程并改善患者生活品质,因此这些治疗本身就有缓和医疗的意味。
帕金森病患者应在疾病早期就接受缓和医疗,而非等疾病恶化后再进行。缓和治疗师能协助患者减轻身体症状和情绪方面的问题,包括身体功能低落而导致失业、忧郁、恐惧或存在意义上的担忧。
给予情绪支持的同时,缓和医疗也担负着向患者和家属说明治疗目标的任务。随着病程进行,帕金森病的患者可能会面临困难的抉择,例如是否插 鼻胃管 ( 英语 : feeding tube )、非侵袭性正压呼吸器( 英语 : non-invasive ventilation ) 或执行气切,或是要不要做心肺复苏术,以及何时该进安宁病房。缓和医疗团队能够协助回答这些问题,并在复杂的医疗资讯和情绪问题间给予患者指引,帮助患者做出最佳的选择 。
其他治疗
控制消化系统的神经和肌肉也可能受到帕金森病的影响,导致便秘和胃轻瘫( 英语 : gastroparesis )(即胃下垂,指食物停留在胃内较长时间)。借由定期营养评估制订均衡的饮食能避免患者体重减少,并使肠胃道功能减退造成的影响降到最低 。当疾病更形严重后,也可能出现吞咽困难的症状,在用餐时添加 增稠剂 ( 英语 : thickening agent )并把身体挺直或许有助于进食,同时能减少噎到的风险。对于更严重的患者可能会采用胃造口术( 英语 : Gastrostomy ),直接将食物送到患者的胃中。
L-多巴和蛋白质使用同一套运输系统穿越肠壁和血脑障壁,因此会彼此竞争,当两者同时出现时,便会减少药物的效用。因此,服用L-多巴的患者不应该摄取高蛋白饮食,较推荐的饮食种类则是地中海饮食。在疾病较为严重的时候,基于相同的原因,也会建议患者摄取低蛋白饮食。为了减少蛋白质造成的交互作用,患者必须在餐前30分钟服用L-多巴。同时,给帕金森病患者的处方也会限制患者早餐和午餐的蛋白质摄取,让蛋白质尽量在晚上吸收。
重复性经颅磁刺激术( 英语 : Repetitive transcranial magnetic stimulation ) (rTMS)能暂时改善L-多巴造成的运动困难 ,但其效用仍在研究当中,近期也有研究显示rTMS没有效果。数种营养素被认为有治疗的潜力,但目前仍无证据显示维生素或其他食品添加剂能改善症状。此外,目前也无证据证明针灸、气功或太极拳对疾病的进程或症状有任何效果,太极拳是否能改善患者的平衡或运动能力仍有待进一步的研究 。蚕豆和刺毛黧豆是帕金森病患者补充L-多巴的天然来源,虽然它们在临床试验当中已经展现出了一定的效果,但摄取此类食物也有对应的风险,如产生 抗精神药物恶性综合征( 英语 : neuroleptic malignant syndrome ) 等可能危及生命的副作用。
预后
统一帕金森病评定量表( 英语 : Unified Parkinson"s Disease Rating Scale ) (UPDRS)是最常用来评估帕金森病严重程度的方法,但由于此量表有较不重视运动以外症状的限制,因此现在更倾向使用由此量表改良过的MDS-UPDRS。宏恩亚尔分级表则是一种较旧的评估方法(最初于1967年发表),它将帕金森病的进程分为五个阶段。
若没有接受治疗,患者的运动症状在早期进展得很快,但后来则会趋缓。一般患者在发病八年后会失去独立步行的能力,并需卧病在床。虽然现在不太容易找到没有接受过治疗的人,医疗已经改善了运动综合征的预后,但与此同时,长期使用L-多巴造成的副作用也导致一些病患出现运动障碍。使用L-多巴的人,从症状开始出现到需要高度依赖照护的时间可能超过15年。目前还是难以预测单一病例的疾病进程,年龄是预测帕金森病进程最好的指标 ;在诊断出帕金森病时运动症状较轻微的病患,之后的功能减退也会比较少;认知功能障碍则在70岁以上才发病的老人中较为普遍。
由于现在的治疗已经大幅改善运动问题,目前疾病造成的障碍大多显现在运动以外的症状。然而,疾病的进程与功能减退程度呈非线性关系,患者的症状一开始通常是运动症状,随着疾病进展,药物疗效较差的运动症状和药物导致的并发症会更加明显,前者包括吞咽、言语困难和步态不稳等平衡性问题;后者则常发生在使用L-多巴的患者,使用L-多巴超过五年的患者有一半以上会产生并发症。发病十年后,大多数的帕金森病患者最终会出现自律神经疾患、睡眠障碍、认知功能减退等问题,这些症状(尤其是认知功能减退)是造成患者残障的主因。
帕金森病患者的预期寿命较一般人短,死亡率( 英语 : Standardized mortality ratio )大约是其他人的两倍,造成患者死亡的风险因子包括认知功能减退和失智、吞咽障碍、老年发病和较严重的疾病状态。另一方面,以颤抖为主要症状的患者较肢体僵硬为主的患者有更高的存活率。帕金森病患者因吸入性肺炎( 英语 : aspiration pneumonia )导致死亡的概率也大约是健康人的两倍。
1990年时,帕金森病造成约44,000名患者死亡;到了2013年,死亡人数则成长到103,000人,这段时间,死亡率由每十万人1.5例增加到了1.8例。
流行病学
帕金森病为继阿兹海默病之后,第二常见的神经退行性疾病。全球罹患帕金森病的患者约有700万人,其中美国就占了约100万人。在工业化国家中,本疾病的盛行率约为0.3%,且患者主要集中于高龄人口。60岁以上每增加一岁,盛行率便提高1%;80岁以上则每增加一岁就增加4%。帕金森病的平均发病年龄约为60岁,但有5–10%患者属于早发型帕金森病(young onset PD,YOPD),此类患者会在20至50岁间发病。有研究显示帕金森病在非裔及亚裔的盛行率较低,但此结果仍有争议 。也有研究认为男性的罹病率较女性高,但有些研究不支持这个结果。帕金森病的发生率约介于每年每十万人8至18人之间。
许多危险因子与保护因子都已发现,有些与目前推测的致病机转有关,无论如何,目前还没有任何一个因子与临床反应的关联性获得证实。虽然有数项研究试图阐明帕金森病与某些因子之间的关系,然而研究设计上多有瑕疵,且有些结果互相抵触。目前结果一致性最高的两项因子分别是暴露于杀虫剂会提升风险,而吸烟则会减低风险。
历史

让-马丁·沙可(图)为纪念詹姆士·帕金森 ( 英语 : James Parkinson ) ,将疾病定名为“帕金森病”。沙可对于帕金森病的研究有重大贡献。
早在远古时代,就有相关文献纪载类似帕金森病的症状。印度医书《阿育吠陀》中,有纪录一种名为“坎帕吠陀”(kampavata)的疾病,就描述了类似帕金森病的症状,包含颤抖及运动困难等。书中还提到可用刺毛黧豆进行治疗,后续研究发现其植物体内含有L-多巴的成分。
其他文献,如古埃及草纸文献、中国最古老的医书《黄帝内经》、《圣经》和盖伦的著作都有描述类似的症状。但自盖伦之后则未见类似的症状纪录 ,直到17至18世纪开始, 西尔维斯( 英语 : Franciscus Sylvius ) 、 高比乌斯 ( 英语 : Hieronymus David Gaubius ) 、 亨特 ( 英语 : John Hunter (surgeon) ) 及 肖梅尔 ( 英语 : Auguste François Chomel )等人才又纪录了该疾病的相关资讯 。
1817年,英国医师 詹姆士·帕金森 ( 英语 : James Parkinson ) 在其论文《论震颤性麻痹》( An Essay on the Shaking Palsy )中纪录了六个震颤性麻痹的病例 。帕金森在文中描述了帕金森病的典型症状,包含静止性颤抖、步态及姿势异常、肢体僵硬、肌力退化等等,并记录了疾病的进程。之后特鲁索( 英语 : Armand Trousseau ) 、 高尔斯 ( 英语 : William Richard Gowers )、威尔森( 英语 : Samuel Alexander Kinnier Wilson ) 和 欧勃 ( 英语 : Wilhelm Heinrich Erb ) 等人又对该疾病进行更深入的研究。在该疾病的早期研究者中,最知名的当属让-马丁·沙可,他在1868年至1881年间对该疾病进行详细的研究,留下不可磨灭的贡献,并将该疾病定名为“帕金森病”,以纪念詹姆士·帕金森医师;除此之外,他也给出了肌肉僵硬(rigidity)、无力(weakness)和动作迟缓(bradykinesia)的明确定义以兹区别。
1912年,弗德里克·路易( 英语 : Frederic Lewy )在观察病变脑神经组织后,发现显微镜下的组织可看到一种特殊颗粒状构造,后人因此将其命名为路易氏体( 英语 : Lewy body )。1919年,康士坦丁·特列季亚科夫( 英语 : Konstantin Tretiakoff )发现患者主要受损的区域为中脑的黑质,然而当时该发现并未受到重视。直到1938年,洛夫·海瑟勒( 英语 : Rolf Hassler )在其进一步的研究著作中证实了该发现,特氏的发现才为人们接受。1950年代,阿尔维德·卡尔森和奥莱·霍尼克维兹( 英语 : Oleh Hornykiewicz )分别对于多巴胺的神经传讯功能,及其在帕金森病的影响进行深入研究,使人们对于该疾病的生化机转有了更充分的了解。1997年, 斯皮兰蒂尼( 英语:Maria Grazia Spillantini )、特罗扬沃斯基( 英语 : John Q. Trojanowski ) 和 高德 ( 英语 : Michel Goedert )等人发现了路易氏体的主要成分为α-突触核蛋白。
在L-多巴问世之前,治疗以给予抗胆碱类药物及手术(破坏部分锥体束及基底核构造)为主。1911年,卡西米尔·冯克首次合成L-多巴,但在20世纪中叶以前并没受到重视 。1967年,L-多巴成为帕金森病的临床用药,迅速取代了旧有的疗法。1980年代,法国科学家阿里姆·路易斯·本纳比( 英语 : Alim-Louis Benabid )等人发展了脑深层刺激手术,为帕金森病的治疗带来新的研究方向及可能性。
社会与文化
社会支出

“认知帕金森”("Parkinson"s awareness")活动的标志,标志中央为一朵红色郁金香。
帕金森病带来庞大的社会成本,实际金额因方法问题及国别差异而难以计算。英国每年花费于帕金森病的金额估计在4.49亿至33亿英镑之间;美国则约为230亿美金,平均每名病患每年花费约1万美金 ,其中最大一部分用于住院治疗( 英语 : inpatient care ) 和护理之家,其次则为药物花费。2006年上海的统计指出该地每名帕金森病患者每年平均花费7679人民币,这个数目是当地平均所得的一半,其中最大的开销来自药物花费。除了直接成本外,帕金森病也带来钜额的间接成本,例如患者的生产力下降,并连带加重照顾者的劳力与经济负担,且影响到双方的生活品质。
倡议
为提升公众对于该疾病的重视,欧洲帕金森病协会将詹姆士·帕金森的生日(4月11日)订为每年的世界帕金森日(World Parkinson"s Day)。2005年,国际组织将红色郁金香选为本疾病的象征,原因是一位荷兰的园艺家威尔德(J.W.S. Van der Wereld)将其于1981年培育出来的栽培品种命名为“詹姆士·帕金森郁金香”。美国帕金森基金会( 英语 : National Parkinson Foundation )自1982年起每年提供1.8亿美金,赞助帕金森病相关的照护、研究及服务。帕金森病基金会(英语: Parkinson"s Disease Foundation )由威廉·布拉克(William Black)在1957年所创办,自成立以来已捐助了1.15亿美金于相关研究、5000万美金于教育及推广计划。其他还包含1961年成立的美国帕金森病协会( 英语 : American Parkinson Disease Association ),以及1992年成立的欧洲帕金森病协会 ( 英语 : European Parkinson"s Disease Association )。
著名病例

在世界经济论坛上的穆罕默德·阿里,时年64岁。阿里从38岁起即有帕金森病的症状,直至其逝世。
演员迈克尔·J·福克斯在罹患帕金森病后,引起公众对此疾病的重视。福克斯在确诊后,选择面对疾病,甚至在不服药的情形下,于公共节目演出,真实呈现疾病的影响。他还写了两部自传,叙述其对抗此病的历程。此外,福克斯还曾在不服药的情形下于美国国会内说明疾病的影响,并成立迈克尔·J·福克斯基金会 ( 英语 : The Michael J. Fox Foundation ),以寻找治愈帕金森病的方法。卡罗琳学院为肯定福克斯于帕金森病研究上的支持与贡献,颁予他名誉医学博士学位 。
曾获奥林匹克铜牌的自行车手戴维斯·菲尼( 英语 : Davis Phinney )于40岁时发现有青年帕金森病。于是菲尼于2004年创办了戴维斯·菲尼基金会( 英语 : Davis Phinney Foundation ),资助提升患者生活品质的相关研究。
穆罕默德·阿里于38岁时出现帕金森病的症状,但迟至42岁才确诊,有“全世界最知名的帕金森病患者”之称。但阿里罹患的是帕金森病还是拳击手型痴呆症( 英语 : Dementia pugilistica ),迄今仍未有定论。
研究
近期帕金森病新疗法的进展很有限,目前的研究方向包括寻找新的模式生物、开发基因治疗、干细胞移植和神经保护( 英语 : neuroprotective )性物质。
模式动物
目前尚未在人类以外的动物发现自发性帕金森病,但研究上已经使用具有某些特性的动物作为模式动物。诱发实验动物产生帕金森病候群的技术来自于一场意外。1980年代,一批服用鸦片剂( 英语 : opiate ) “MPPP”的药瘾者产生了帕金森病候群的征象,经追查发现后发现这些药物受到另一种化学物质MPTP的污染,从此之后,MPTP成为了实验室用来诱发实验动物产生帕金森病候群的药物。除了MPTP以外,有些毒物如用作杀虫剂的鱼藤酮、杀草剂百草枯和杀真菌剂锰乃浦( 英语 : maneb ) 也有类似的效果,这类毒素诱发模式通常用于灵长类动物实验上。目前也发展出可诱发不同症状的克隆啮齿类模式。从黑质注射神经毒素 6-羟多巴胺( 英语 : 6-hydroxydopamine )(6-OHDA)可专一地摧毁黑质纹状体路径的多巴胺神经元 。
基因疗法
一般基因疗法的概念是利用非感染性的病毒(如腺联合病毒( 英语 : adeno-associated virus ))作为载体,将基因片段送入目标细胞中。这些基因可以协助制造改善帕金森病的酵素,使大脑免于受到伤害 。迄2010年,全球有四个帕金森病案例以基因疗法进行治疗 ,但治疗的副作用及效果仍有待观察 。其中一个试验者在2011年的论文中表示有改善 ,但进行试验的药厂Neurologix已在2012年3月宣告破产 。
神经保护疗法
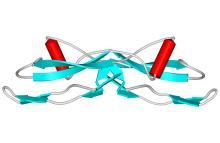
有些化学分子如 GDNF ( 英语 : Glial cell line-derived neurotrophic factor ) (如图示)被认为可用作帕金森病患者的神经保护物质,但其效果尚未证实。
神经保护( 英语 : neuroprotective ) 目前是帕金森病相关研究中最尖端的题材之一,目前已报导数种化学物质具有治疗潜力,但尚未证实有任何物质能减缓退化。现今仍在进行研究的物质包含抗细胞凋亡物质( omigapil ( 英语 : omigapil )、CEP-1347)、抗谷胺酸药物、单胺氧化酶抑制剂( 希利治林( 英语 : selegiline ) 、雷沙吉兰)、促线粒体生物能转换剂(辅酶Q10、肌酸)、钙离子通道阻滞剂( 艾雷待平 ( 英语 : isradipine ) )和生长因子( GDNF ( 英语 : Glial cell line-derived neurotrophic factor ) )等。也有研究以 α-突触核蛋白 ( 英语 : alpha-synuclein ) 作为治疗标靶 ,针对α-突触核蛋白( 英语 : alpha-synuclein ) 的疫苗PD01A现在已进入人体临床试验。
神经移植
自1980年代初期,已经有多人尝试将胎儿、猪、颈动脉或视网膜组织移植到黑质,以期修复黑质与大脑间的神经联系。虽然有初步证据显示移植中脑的多巴胺神经元可能有效,但双盲试验目前仍显示无长期效益。此外,移植组织可能会释放过量的多巴胺,造成肌张力障碍。干细胞移植为现今研究焦点,因为干细胞方便操作,且在猴子与啮齿类身上的实验显示动物不但能成功存活,还能减少行为异常。然而,胚胎干细胞的使用迄今仍有相当争议( 英语 : Stem cell controversy )存在,因此可能会朝向使用较无争议的诱导性多功能干细胞(iPS)进行研究。
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

相关资料

- 有价值
- 一般般
- 没价值








24小时热门
推荐阅读
知识互答
关于我们

APP下载




























{{item.time}} {{item.replyListShow ? '收起' : '展开'}}评论 {{curReplyId == item.id ? '取消回复' : '回复'}}