



双分子消除反应
历史
双分子消除反应为1920年代,克里斯托夫·英果尔德(Christopher Kelk Ingold)与罗伯特·鲁宾逊(Robert Robinson)展开了一连串有机化学的研究,提出了许多现代有机化学里的观念,像是亲核性、亲电性、SN1反应、SN2反应、E1反应、E2反应等等都是在他们研究后先后提出来的崭新概念,这些概念的提出对揭示有机反应内在机理从而实现控制有机反应起到了巨大的促进作用,而E2反应,就是他们提出来解释消除反应的其中一项反应机构。
反应机构
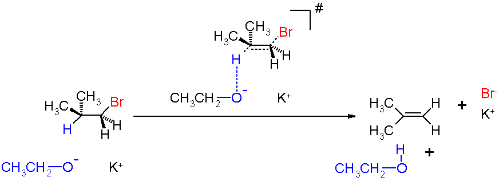
上图乙醇作为碱攻击β-氢。溴带着共用电子对在离去基作用下离去,而氢以质子的方式离去。
如同S N 2反应,反应由一步完成,但不同的是由碱来拉走质子,而并不是当作亲核试剂,碱进攻β-氢,并与离去基同时离去,生成烯烃。而由于反应为一步完成,与二种反应物浓度皆有关,在反应动力学上是属于二级反应。
特性
而因为E2反应不需侵入重围,攻击之中的碳原子,只需从旁拉走一个质子,因此立体阻碍在此并不如S N 2反应般发生影响,因此在一、二、三级受质皆可发生反应,而因为E2反应不会产生碳阳离子,故不会发生重排现象。E2反应为一步反应,因此碱的强弱对其反应速率有很显著的影响,越强的碱能使反应进行越快,而对于离去基来说,E2反应需要好的离去基方能进行反应,但离去基的影响相较于E1反应并没有如此敏感,但是离去基越强,皆能增加E1及E2的反应速率。 双分子消除反应与单分子消除反应和单分子亲核取代反应互为竞争反应。但由于E1反应较难发生,所有条件都必须恰到好处,(三级受质、弱碱、极好的离去基),如果三个条件有一样稍微不同,反应都较倾向于遵循E2反应机构。因此,因E2反应较为常见,特别是在三级受质的情况下,能使反应迅速发生。 在E1反应中,区域选择性使其反应遵循查依采夫规则,得到的产物会出现顺、反二种顺反异构物。但E2反应则不然,E2反应具有立体特异性,反应中的氢必须与离去基处于反式共平面(antiperiplanar),因此只会得到其中一种立体异构物。
比较
最后可将上述的结果整理成表格如下:
E2反应与S N 2反应的比较:
相关条目
单分子消除反应
参考文献及资料
David R. Klein. 有机化学天堂秘笈. Taiwan: 天下远见出版股份有限公司. Oct 19, 2007: 302~309. ISBN 978-986-216-008-4 .
卤代烃. Jan 28, 2010 .
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

- 有价值
- 一般般
- 没价值








推荐阅读


关于我们

APP下载


















