更多文章
更多精彩文章

单分子亲核取代反应
S N 1 亲核取代反应机理如下:
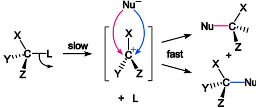
第一步是原化合物的解离生成碳正离子和离去基团,然后亲核试剂与碳正离子结合。由于速控步为第一步,只涉及一种分子,故称 S N 1 反应。
常发生于:
碳上取代基较多(如:(CH 3 ) 3 CX),使得相应碳正离子的能量更低,更加稳定。同时位阻效应也限制 S N 2 机理中亲核试剂的侵蚀。
对碳阳离子生成有利条件:有许多释电子基团帮助稳定碳阳离子的正电荷(3级碳>2级碳>1级碳),一级碳几乎不能够单独存在,而会立刻和周遭发生化学反应而形成内能更低的分子。
S N 1 亲核取代反应特点:
反应速率决定步骤在于离解一步(第一步),所以根据动力学理论推断该反应为一级速率反应, r = k [ {\displaystyle \ r=k[} 反应物 ] {\displaystyle \ ]} 。
从立体化学观点来看,该反应的反应物若为光学异构物之一,则产物反转概率略大于50%。在碳阳离子形成时,整个分子略呈现平面三角形,亲核体可以由平面三角形上下两侧进行攻击,形成新分子。故理论上反转概率为50%,但因原先脱离的阴离子影响碳阳离子,故亲核剂倾向由反侧攻击形成反转的产物。
该反应适合在高极性稍有质子性溶剂中进行,高极性有助于利用本身极性带有的部分负电稳定碳阳离子,稍有质子性溶剂提供质子与较强亲核剂(通常是被脱离的)化合有助于反应平衡往产物移动。
双分子亲核取代反应
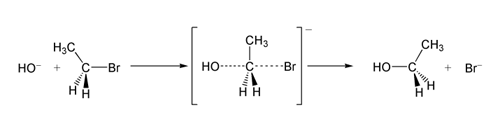
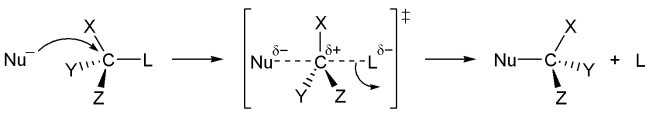
S N 2 亲核取代反应机理如下:
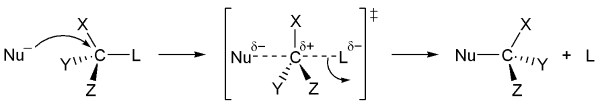
较强亲核剂直接由背面进攻碳原子,并形成不稳定的一碳五键的过渡态,随后离去基团离去,完成取代反应。
常发生于:
碳原子取代较少(如:CH 3 X),可较容易使 S N 2 反应发生。(原因是碳原子上有烷基取代时会有供电效应使被进攻的碳正电性减弱,且烷基取代会产生空间位阻,阻碍进攻)
对碳正离子生成有不利条件的环境下:有许多拉电子基或较少推电子基(1级碳>2级碳>3级碳)。
S N 2 亲核取代反应特点:
反应速率决定在两个因素上:强亲核剂的浓度高低与反应物的浓度高低,所以根据理论推断该反应为典型的二级速率反应, r = k [ {\displaystyle \ r=k[} 反应物 ] [ {\displaystyle \ ][} 亲核试剂 ] {\displaystyle \ ]} 。
从立体化学观点来看,该反应反应物若为光学异构物之一,则产物构型翻转概率为100%(完全反转),因为只能从反侧攻击,故产物必定反转。
反应适合在高极性非质子性溶剂中进行,高极性有助于稳定反应中间体,非质子性溶剂则不会与强亲核剂化合而导致反应平衡往反应物移动。
参见
亲核芳香取代反应
单分子共轭碱亲核取代反应
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。












{{item.time}} {{item.replyListShow ? '收起' : '展开'}}评论 {{curReplyId == item.id ? '取消回复' : '回复'}}