更多文章
更多精彩文章

分类
环加成反应有两种分类方法。一种是根据参加反应的原子数标记,写为 ( i + j + . . . ) {\displaystyle (i+j+...)\,} 的形式。 i 和 j 等是参加反应的每个分子或某个分子的不同部分提供的原子数,反应后形成的新环含有的原子数应为 i + j +...。例如,狄尔斯-阿尔德反应记为(4+2)环加成反应,1,3-偶极环加成反应(如烯烃臭氧化反应的第一步加成)记为(3+2)环加成反应。
第二种是IUPAC鼓励的分类方法,也就是按照参加反应的电子数来标记,写为 [ i + j + . . . ] {\displaystyle [i+j+...]\,} 。在这种命名方法下,降冰片二烯与活化炔烃的反应记为[2+2+2]环加成反应,狄尔斯-阿尔德反应记为[4+2]环加成反应,而烯烃臭氧化的第一步反应则记为[2+2]环加成反应。此外,还可以进一步用下标表明反应的其他性质。a代表异面,s代表同面,写在数字的后下方;轨道性质(σ、π、n)写在数字的前下方。这样,狄尔斯-阿尔德反应便可记作 [ π π --> 4 s + π π --> 2 s ] {\displaystyle [_{\pi }4_{s}+_{\pi }2_{s}]\,} ,表明一个反应物给出4个π电子,另一个反应物给出2个π电子,它们发生的是同面-同面加成。
反应机理
在加热时发生环加成反应的原料多为(4n+2)体系,受轨道对称性影响,反应以同面-同面加成或异面-异面加成(少见)进行。同面指π键同一侧的两个轨道瓣进行反应,异面对应异侧。少数4n体系反应物的环加成反应是允许的。它们为同面-异面加成机理,例如在烯酮的二聚反应中,烯酮正交的 p 轨道促使交叉中间体的生成,使得反应可以进行,生成产物二烯酮。
4n体系底物可以在受光作用下,HOMO(π成键轨道)的一个电子被激发到LUMO(π*反键)上,这样激发态的HOMO与基态的LUMO波相符合,可以发生同面-同面加成。下面肉桂酸受光激发二聚为环丁烷衍生物的反应便是一个例子。
一般地讲,环加成反应具有以下选择性规则:
以上规则只表明反应按照协同机理进行的活化能大小,并不排除反应按照其他机理进行。例如,按反应选择性规则,(2+2)环加成反应在加热时是对称性禁阻的,但二氟二氯乙烯在200°C时形成四氟四氯环丁烷似乎与以上规则相矛盾。实际上,该反应是通过一个双自由基的反应中间体进行的,并不经由协同机理。这也是很多(2+2)环化反应看上去不符合选择性规则的原因。
有些具有张力的环丙烷环系,由于具有显著的π键性质,也可以发生环加成反应。例如下图中的四环庚烷与DMAD的反应:
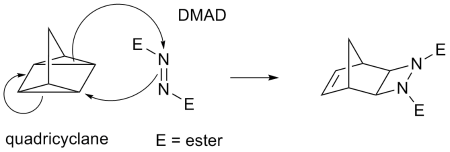
“表环加成”
有些金属催化的环加成反应属于多步的非协同反应,因此被称为“表环加成反应”(Formal cycloaddition),以将它们与一步完成的周环反应相区别。一般来讲,表环加成反应包括的情况有:反应中间体为带有电荷或为自由基;产物由多步反应得到。下面便是一个表[3+3]环加成反应,反应物是一个环状α,β-不饱和酮和一个烯胺,在正丁基锂作用下,发生烯胺烷基化和1,2-加成的连续反应,得到类似于环加成的产物。
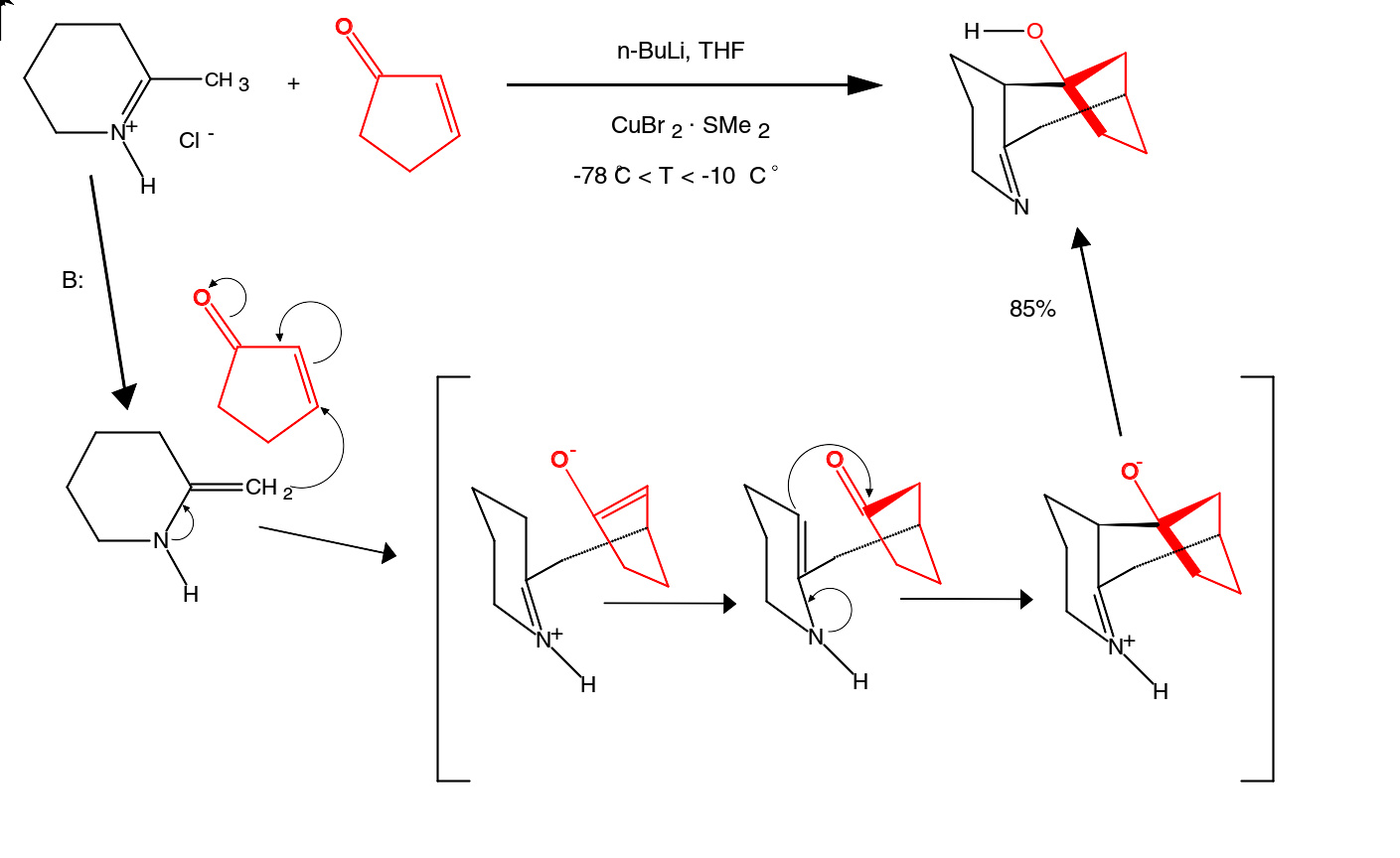
参见
螯变反应
参考资料
^IUPAC金色书对“环加成反应”的定义:[1]。
^ Hein, Sara M. An Exploration of a Photochemical Pericyclic Reaction Using NMR Data. Journal of Chemical Education. June 2006, 83 : 940 – 942.
^ Movassaghi, Mohammad; Bin Chen. Stereoselective Intermolecular Formal [3+3] Cycloaddition Reaction of Cyclic Enamines and Enones. Angew. Chem. Int. Ed. 2007, 46 : 565 – 568. doi:10.1002/anie.200603302 .
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。












{{item.time}} {{item.replyListShow ? '收起' : '展开'}}评论 {{curReplyId == item.id ? '取消回复' : '回复'}}