表观遗传学
词源和定义
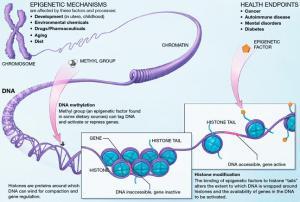
表征遗传机制
由于表征遗传学定义有多种,导致了在表征遗传学代表什么这一问题上出现了分歧。表征遗传学由C. H. Waddington于1942年作为后生论和遗传学的合词而提出 。 后生论是一个很古老的概念 ,现在更多的用于描述胚胎发育过程中的细胞分化源自干细胞的全能状态。当Waddington提出这一词语时,人们对基因的物理性质及其在遗传中的作用还不清楚,使用该词语是表示,基因可能与环境相互作用,并产生表现型的概念。Robin Holliday将表征遗传学定义为“在复杂有机体的发育过程中,对基因活性在时间和空间中调控机制的研究” 。因此,后生论也可用于描述任何影响有机体发育的因素,而不仅仅是DNA序列。 现在科学界对表征遗传学有了更严格的定义。Arthur Riggs及其同事将其定义为,有关引起可遗传的基因功能改变的有丝分裂和/或减数分裂的研究,这些变化以DNA序列改变无法解释 。表征遗传学的希腊语前缀epi-意味着“在…之上”或“除…之外”,因此表征遗传学的特征是传统的分子水平遗传之上或之外的遗传。 “表征遗传学”也被用于描述还未证实的组蛋白修饰的遗传过程,因此可尝试用更广义的术语来重新定义。 例如,Adrian Bird将表征遗传学定义为,染色体的构造适应,以便启始、发出信号或保持变构的活性状态 。这个定义既包括涉及DNA修复或细胞周期的瞬态改变,也包括多代细胞的稳态改变,但是不包含细胞膜结构和朊病毒,除非其影响到染色体功能。但这样的定义并不被普遍接受并仍然受到争议 2008年的冷泉港会议达成了关于表征遗传学的共识,即“由染色体改变所引起的稳定的可遗传的表现型,而非DNA序列的改变 。 与“遗传学”相似的词衍生出很多平行的用法。“表征基因组”是“基因组”的平行词,指的是一个细胞的整体表征遗传状态。“遗传密码”与“表征遗传密码”对应,用于描述不同细胞产生不同表现型的一系列表征遗传特征。“表征遗传密码”可代表细胞的总体状态,按每个分子在表征遗传地图上所占的位置,可得出DNA甲基化和组蛋白修饰状态的特定基因组区域的基因表达图表。更典型的是,这个词用于提及和评估特定的系统性措施,如组蛋白编码或DNA甲基化模型相关的表征遗传学形式。 心理学家Erik Erikson在其著作中提到“后生论”,认为后生规则是“任何生长的事物都有一个平面图,在这个图之外各个部分先后出现,而每个部分都有其特定的优势期,直至所有的部分出现从而形成一个功能整体。” 个用法有一定的历史价值 。
表征遗传学的分子基础
表征遗传的改变可以导致特定基因的激活,而不必改变DNA序列。此外,染色质蛋白与DNA相关联可能被激活或沉默。这是不同的细胞在多细胞有机体中只表达其活动必需基因的原因。当细胞进行分裂时,表征遗传的变化得以保存。 大多数表征遗传变化只发生在生物个体的一生中,但是,如果形成受精卵的精子或卵细胞发生了基因失活,那么这种表征遗传变化将被传递给下一代 。由此拉马克学说提出了一个问题:这种生物体表征遗传的变化是否可改变DNA的基本结构。 特殊的表征遗传过程包括副突变、书签、基因组铭印、基因沉默、X染色体去活化、位置效应、重构、缩并、母体效应、致癌过程、致畸剂影响、组织蛋白修饰及异染色质的调控,最后是受技术局限的单性生殖及克隆。DNA损伤也会导致表征遗传变化 。DNA损伤发生频繁,人体平均每天会发生10000次。这些损伤大部分被修复,但在DNA修复时仍然可能发生表征遗传变化[ 。尤其是双链DNA的断裂可能会引起未编程的表征遗传基因沉默,导致DNA甲基化和促进沉默蛋白质组的修饰(染色质重构) 。此外,多聚二磷酸腺苷核糖酶(Parp1酶)及其产物多聚二磷酸腺苷核糖(PAR)在修复过程中会积聚DNA的损伤 。这种累积,反过来,直接补充和激活染色质重塑蛋白ALC1进而导致核小体的重构 。而核小体的重构会导致DNA修复基因MLH1的沉默 。能造成DNA损伤的化学物质,如苯、对苯二酚、苯乙烯、四氯化碳和三氯乙烯,可通过激活氧化应激通路导致大量的DNA低甲基化 。 不同饮食影响老鼠表征遗传变化[27]。一些食物成分可增加DNA修复酶、MGMT、MLH1 和p53 和p53 )的水平,另一些食物成分如大豆异黄酮 和花青素 降低DNA损伤。 表征遗传研究广泛使用分子生物学技术,如染色质免疫沉淀、荧光原位杂交法、甲基化敏感限制酶、DNA腺嘌呤甲基转移酶识别、亚硫酸盐定序等,从而帮助人们更深入地理解表征遗传现象。此外,生物信息学也发挥着越来越重要的作用(计算表征遗传学)。计算机模拟和分子动力学方法揭示了原子运动与组蛋白尾端变构分子的识别有关. 。
机制
一些类型的表征遗传系统在细胞记忆中可能扮演重要角色 ,然而需注意的是,并不是所有的表征遗传学例子都能被普遍接受。
DNA甲基化和染色质重构
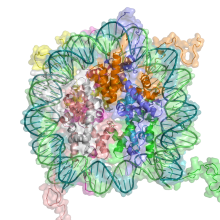
DNA与组蛋白结合形成染色质
细胞核个体的表现型受到自身基因转录的影响,因此可遗传的转录能提高表征遗传效应。基因表达分多层调控,基因调控的一种途径是通过染色质重构。染色质是DNA和组蛋白结合的复合体,DNA缠绕着组蛋白球体,若DNA缠绕组蛋白的方式发生改变,基因表达也将改变。染色质重构通过以下两个主要机制完成:
第一条途径是组成组蛋白的氨基酸的平移修改。组蛋白由长链氨基酸构成,如果链中的氨基酸改变,组蛋白的形态将发生改变。复制期间的DNA并非完全解链,因此,经过修改的组蛋白可能被用于每个新复制的DNA,这些组蛋白将作为模板,以新的方式合成新形态的组蛋白。通过改变周围蛋白的形态,这些修改的组蛋白将确保分化的细胞保持分化状态,而不是重新回到干细胞状态。
第二条途径是通过增加位于CpG岛上的DNA的甲基,使胞嘧啶转化为5-甲基胞嘧啶。5-甲基胞嘧啶同正常的胞嘧啶一样与鸟嘌呤配对,然而,基因组某些区域的甲基化较多,甲基化较高的区域通过不完全清楚的机制使得转录的活力减小。甲基化的胞核嘧啶也可以从父母一方的生殖细胞保留在受精卵中,标记染色体遗传自双亲(遗传印记)。
细胞分化过程中DNA甲基化将导致组蛋白性状的变化。某些酶(如DNMT1 )对甲基化胞嘧啶有较高的亲和力。如果这种酶达到DNA的“半甲基化”部分(两条DNA链中只有一个甲基胞嘧啶),这种酶将催化另一部分。 虽然组蛋白修饰发生在整个序列中,非结构化的N-末端的蛋白(称为组蛋白尾端)特别容易被修改。这些修改包括乙酰化,甲基化,泛素化,磷酸化和修饰作用。乙酰化是这些修饰中研究得最多的。例如,组蛋白H3尾部的K14和K9赖氨酸被组蛋白乙酰转移酶(HATs)乙酰化通常与转录能力有关。 有人认为这种与“激活的”转录有关的乙酰化倾向于是一种生物物理学改变。因为通常在组蛋白末端有一个带正电荷的氮,赖氨酸可以与DNA主链带负电荷的磷酸盐结合。乙酰化使侧链上带正电荷的氨基团变成中性的酰胺键。正电荷的去除,使DNA从组蛋白上解开。这时,SWI/SNF和其他转录因子复合体就可以结合到DNA上使转录开始。这是表征遗传作用的“顺式”模型。就是说,组蛋白尾部改变对于DNA本身有一种直接效应。 另一种表征遗传作用模型是“反式”模型。在这个模型中,组蛋白尾部改变对DNA起间接作用。例如,赖氨酸乙酰化可以为染色质修饰酶(和基础转录装置)产生一个结合位点,然后该染色质重构体导致染色质状态改变。实际上,布罗莫结构域——一个特异性与乙酰-赖氨酸结合的蛋白片段(域)——发现其帮助很多酶激活转录,包括SWI/SNF复合体(在polybromo蛋白上)。乙酰化可能作用于此和之前的途径而帮助转录激活。 组蛋白甲基化也证实了由相关因素导致的对接模块作为一种修饰方式的推断。组蛋白H3赖氨酸9的甲基化与组成型转录沉默染色质(组成型异染色质)有关。已确定转录阻遏蛋白HP1的一个染色质域(特异性结合甲基-赖氨酸的域)在HP1到K9的甲基化区域发挥作用。而一个看起来像反驳甲基化的生物物理学模型,赖氨酸4上的组蛋白H3的三甲基化与转录激活强相关(且完全需要)。三甲基化将在组蛋白尾部引进一个固定正电荷。 已研究证明,组蛋白赖氨酸转甲基酶(KMT)在组蛋白H3和H4模式中负责甲基化激活。该酶利用一个叫SET域(Suppressor of variegation,zeste增强子,Trithorax)的催化活性位点。SET域是一个130个氨基酸的序列,参与调控基因活化。已证实其可与组蛋白尾部结合,导致组蛋白甲基化。 不同的组蛋白修饰可能通过不同的方式起作用;一个位置的乙酰化可能比另一个位置的乙酰化发挥更加不同的作用。另外,同时可以发生多重修饰,这些修饰可以一起工作来改变核小体的行为。多重动态修饰以一种系统的和可繁殖的方式调节基因转录叫做组蛋白密码。 DNA甲基化频繁发生于重复序列,帮助抑制表达和“转座子”的流动性:: 由于5-甲基胞嘧啶可以自发脱氨基(用氧替代氮)变成胸苷,除了CpG岛保持未甲基化外,CpG位点经常发生变化,其在基因组中逐渐变得稀少,。因此这种类型的表征遗传改变具有直接增加永久的基因突变频率的潜力。已知DNA甲基化通过至少三个独立的DNA甲基转移酶的复杂的相互作用而对环境因子做出反应,从而使其得以建立和修改,DNMT1,DNMT3A和DNMT3B,其中任何一个缺失对于小鼠都是致命的。DNMT1在体细胞中是最多的转甲基酶, 局限在复制中心。 对于半甲基化的DNA具有10-40倍的优先权,并与增殖细胞核抗原(PCNA)发生相互作用。 通过优先修饰半甲基化的DNA,DNMT1在DNA复制后将甲基化模式转移给一条新的合成链,因此经常作为“维持”甲基转移酶被提及。 DNMT1对于适当的胚胎发育、印刻铭记和X失活是必需的。 为了强调这个遗传分子机制与权威的瓦特生-克里克遗传信息的碱基配对遗传机制的区别,引进了“表征遗传模板”这个术语。 此外,除了维持和传送甲基化DNA状态,相同的原理也能作用于保持和传送组蛋白修饰,甚至细胞质(结构上)的遗传状态。 组蛋白H3和H4也能利用组蛋白赖氨酸脱甲基酶(KDM),通过反甲基化而调节。这个最近被确认的酶有一个叫Jumonji域(JmjC)的催化活性位点。当JmjC使用多个辅助因子使甲基团羟基化时,发生了反甲基化,由此除去甲基。JmjC能够对单、双和三甲基化底物进行脱甲基。 染色体区域能够采用稳定的和可遗传的二选一的状态导致无DNA序列变化的双稳态的基因表达。表征遗传控制经常与非正统的组蛋白共价修饰有关。 的染色体区域的稳定性和遗传性状态经常被认为包含正反馈,在那里被修饰的核小体动员酶对附近的核小体进行类似的修饰。这一发现证实了表征遗传学的一种简化随机模型。 由于DNA甲基化和染色质重塑在很多表征遗传类型中发挥着核心作用,“表征遗传”这个词有时被用来作为这些过程的一个同义词。然而,这可能是有误导性。染色质重塑不一定遗传,而且不是所有的表征遗传都包括染色质重塑。 有人认为组蛋白密码能够被小RNAs的作用所调节。最近发现和界定的一种大量的小的(21-到26-nt)非编码RNAs,提示有一种RNA组分可能参与表征基因调控。小干扰RNAs能通过靶启动子的表征遗传调节来调节转录基因表达。
RNA转录本及其编码蛋白
有时,一个基因被发动后转录成保持该基因活性的产物(直接或间接)。例如,Hnf4和MyoD通过编码蛋白的转录因子活性而分别加强很多肝脏和肌肉特异性基因的转录,包括它们自己的转录。RNA信号传输包括有区别的募集同层次的一般染色质修饰复合体和在分化及发展中通过RNAs使DNA转甲基酶到特定的位点。 其他表征遗传变异由RNA不同粘接形式的产物或双链RNA(RNAi)的形成来介导。即使基因活化的原始刺激已经不存在,基因被发动的细胞的后代也将继承这种活性。这些基因对一些系统合胞体或缝隙连接很重要,常常被信号转导打开或关闭,,RNA可以通过扩散直接传播到其他细胞或细胞核中。大量RNA和蛋白通过母亲卵子形成过程或通过足细胞促成受精卵,导致母体效应的表型。少量精子RNA来自于父亲,但最近证明该表征遗传信息能导致几代后代的明显改变。
微小RNAs
微小RNAs(miRNAs)是非编码RNAs的成员,大小范围从17到25个核苷酸。正如王等研究的, 微小RNAs调节植物和动物各种各样的生物功能。迄今为止,2013年在人类中以发现大约有2000种微小RNAs,都可以在在线微小RNAs数据库中找到。 在细胞中表达的每一种微小RNAs可靶向约100到200种由其下调的信使RNAs。 多数信使RNAs的下调通过靶向信使,使RNA发生衰退,另一些下调发生在翻译成蛋白的水平。 大约60%的人类蛋白编码基因由微小RNAs调节。 很多微小RNAs由表征遗传调控。约50%的微小RNA基因与CpG岛有关, 其可能被表征遗传甲基化抑制。来自甲基化的CpG岛的转录被强烈抑制并可遗传。 其他微小RNAs通过组蛋白修饰或通过DNA甲基化和组蛋白修饰组合来进行表征遗传调节。
小RNAs
小RNAs是在细菌中发现的小的(50-250的核苷酸),高度结构化的,非编码的RNA片段。小RNAs控制基因表达,包括病原体毒力基因,并被认为是与细菌耐药性作斗争的新靶点。 小RNAs在很多生物进程中发挥重要作用,与原核生物靶向信使RNA和蛋白结合。对小RNAs的系统发育分析,例如通过小RNA-信使RNA靶向互动或蛋白结合特性,可建立综合数据库。 同时也建立了与微生物基因组的目标相关的小RNA-基因图谱。
朊病毒
朊病毒是蛋白质有传染性的部分。通常,蛋白质折叠成执行不同细胞功能的不相关的单元,但有些蛋白质也能形成有传染性的构象状态,如已知的感染性蛋白质。虽然曾经认为朊病毒具备将相同蛋白质的其他原生状态催化转变为一种有传染性构象状态的能力,但在以后的研究中,又认为其是表征遗传的代理,具有不修饰基因组而引起表型改变的能力。 真菌朊病毒被认为具有表征遗传,原因是由感染性蛋白质引起的感染性表型能够不修饰基因组而遗传。1965年和1971年在酵母菌中发现的PSI+和URE3,是这种感染性蛋白质中研究最为充分的两个。 阮病毒可以通过抑制表型效应蛋白的聚集,从而降低蛋白质的活性。在PSI +细胞,Sup35蛋白质的损失(参与翻译终止)导致核糖体终止密码子翻译率更高,抑制其他基因中无意义突变。Sup35形成朊病毒的能力可能一直存在。它可以赋予细胞适应性优势,使之能够切换到PSI+状态,表达休眠基因,而通常,这些特性被终止密码子突变所抑制。
结构遗传系统
在纤毛虫像是四膜虫和草履虫中,基因完全相同的细胞在其表面有着不同且可遗传的纤毛纹,以实验改变的纤毛纹可传给子代,似乎存在一种结构起到模板的作用,这种遗传机制尚未清楚,但有理由假设多细胞生物也会利用现存的细胞结构来组装个新的。
功能和影响
发育
体细胞表征遗传通过表征遗传修饰,特别是通过DNA甲基化和染色质重塑,在多细胞真核生物的发育中非常重要。基因组序列不变(有一些值得注意的例外),但细胞区分为很多不同的类型,执行不同的功能,对环境和细胞间的信号做出不同的反应。因此,作为个体发育,成形素激活或抑制在一种表征遗传方式里的沉默基因,赋予细胞一个“记忆”。在哺乳动物中,多数细胞终末分化,仅干细胞保留分化成几种细胞类型的能力(“全能性”和“多潜能性”)。在哺乳动物中,一些干细胞在整个生命中持续产生新分化的细胞,但哺乳动物不能对一些组织的失去做出反应,例如,不能再生肢体,而其他一些动物可以。不像动物,植物细胞不终末分化而保持全能,具有产生一个新植物个体的能力。虽然植物像动物一样利用很多相同的表征遗传机制,例如染色质重塑,已有假说认为一些种类的植物细胞不使用或不要求“细胞记忆”,而用来自环境和周围细胞的位置信息重新设置其基因表达方式来决定其命运。 表征遗传可分为预定的和基于概率的。预定的表征遗传是一种从DNA的结构性发展到蛋白质的功能成熟的单向运动。“预定”在这里指发展是照本宣科和可预见的。另一方面,基于概率的表征遗传是一种随着经历和外部造型的发展的双向结构-功能发育。
医学
表征遗传有各种各样的潜在的医学上的应用,同时它在世界上也趋向多面性。 先天性遗传性疾病很好理解,表征遗传能够发挥作用也很清楚,例如天使人症候群和普瑞德威利症候群。这些疾病像一般的遗传疾病一样由基因缺失或基因失活导致。但是由于基因组铭印的关系,个体本质上是半合子,因此敲除单个基因即足以致病,不像其它的遗传疾病需要两个拷贝都被敲除,所以这些疾病特别容易发生。
进化
当表征遗传改变可遗传时,表征遗传可影响进化。一个隔离的种系或魏斯曼屏障对于动物是特异的,表征遗传在植物和微生物中更为普遍。Eva Jablonka和Marion Lamb已经争论过这些作用,认为可能需要推进现代综合进化论标准的概念框架。 其他进化生物学家则建议结合表征遗传与群体遗传学模型 或表示公开怀疑。 表征遗传有两个重要方式,可与传统遗传相区别,对于进化有重要的作用,这就是表突变率比一般突变率快得多 及表突变更容易逆转。 种表征遗传要素,如PSI阳性系统可充当“临时替代者”,由于短期适应足够好,使得此血统存活足够长,直到突变和/或复合以遗传同化适应性的表型改变。[82] 这种存在可能增强一个物种的进化力。
样本
观遗传改变已被观察到在对环境暴露产生反应时发生,例如,给予膳食补充剂的小鼠具有影响基因表达的表征遗传改变,影响其毛色,体重和患癌症的倾向。 就人类在不同环境暴露下来说,Fraga等研究年轻的和年老的单卵双胞胎。发现尽管这些双胞胎在早年很难从表征遗传上区分,但老年双胞胎在5-甲基胞嘧啶DNA和组蛋白乙酰化的整体含量及基因组分布上具有显著差异。共度时间较短的双胞胎和/或医疗史差异较大的双胞胎在5甲基胞嘧啶DNA和组蛋白H3及H4乙酰化水平差异也更大。 在广泛的有机体范围内,包括原核生物,植物和动物,已有超过100种的跨代的表征遗传现象被报道。 最近的分析提示,胞嘧啶脱氨酶APOBEC/AID家族的成员能够利用类似的分子机制同时调节基因的和表征的遗传。
人类的表征遗传效应
基因组印迹和相关疾病
一些人类疾病与基因组印记有关,在哺乳动物中有一种现象,即父亲和母亲在其生殖细胞中对特定的染色体组位点贡献不同的表征遗传模式。 在人类疾病中众所周知的印记案例是Angelman综合征和普拉德-威利综合征——两者可由相同的基因突变产生,染色体15q部分缺失,这个特别的综合征将依赖于突变是继承于母亲还是父亲而发展。 原因是在这个区域里存在基因组印记。 Beckwith-Wiedemann综合征也与基因组印记有关,经常由母体基因组印记的染色体11上的一个区域异常导致。
跨代表征遗传观察
见主要文章 跨代表征遗传 在Överkalix研究中,Marcus Pembrey等 观察到,在19世纪,瑞典男子如在青春期前遭受营养不良,则其孙子可能较少死于心血管疾病。如果这些男子的食物丰富,那其孙子的糖尿病死亡率就增加,提示这是一种跨代的表征遗传。 在女性中观察到相反的效应——如女子在在内经历过营养不良(且其卵子正在形成),则其孙女的平均寿命短一些。
表征遗传与发育异常
很多致畸剂通过表征遗传机制对胎儿发挥特定作用。 表征遗传效应可以保持致畸剂的作用,如己烯雌酚可以影响儿童的整个生命周期,但由父亲暴露引起后代出生缺陷的可能性因为缺乏理论基础而不能成立。 然而,一系列由男性介导的异常已被证实,如阿扎胞苷 ,FDA规定,当使用5-阿扎胞苷(当其整合进入DNA后形成低甲基化胞苷成为不可甲基化类似物的物质)时,“男性应注意避孕”。证据是:5-阿扎胞苷处理过的雄性小鼠繁殖力下降,增加了胚胎丢失和异常胚胎发育的机会。 在暴露于吗啡的雄性大鼠的后代中观察到内分泌差异。 在小鼠中,己烯雌酚的第二代效应已被描述为是通过表征遗传机制而发生的。 除了形成受精卵的卵子和精子的基因发生表征遗传变化会传递给下一代外,正在发育的胎儿在宫内也会因为母亲暴露于某些因素而发生表征遗传变化。很多流行病学调查显示,胎儿在宫内的生长发育状况与某些成人疾病的发生存在一定的关系。如Barker著名的“成人疾病胎儿起源”假说。该假说认为,胎儿在孕中晚期营养不良,会引起生长发育失调,且成年后易患冠心病。与低出生体重相关的疾病还包括动脉粥样硬化、冠心病、2型糖尿病等。
表征遗传与癌症
多种复合物被认为是表征遗传致癌物——导致肿瘤发生率增加,但不显示诱变活性(有毒复合物和导致肿瘤发生或复发的病原体应该被排除)。实例包括己烯雌酚,亚砷酸盐,六氯苯和镍复合物。最近的研究已显示,系白血病(MLL)基因通过在不同染色体中重排和接合其他基因导致白血病,是一个在表征遗传控制下的过程。 其他研究证实,在许多基因中发生的组蛋白乙酰化改变和DNA甲基化对前列腺癌起作用。 前列腺癌的基因表达可被营养和生活方式改变所调节。 2008年国家卫生研究院宣布,在接下来的5年中将投资1.9亿美元用于表征遗传研究。在宣告书中,政府注意到表征遗传具有解释老化机制,人类发育和癌症起源,心脏病,精神疾病及其他的健康状况的潜力。一些研究者,如杜克大学医学中心博士Randy Jirtle认为,在疾病治疗方面,对于以上疾病,表征遗传学研究可能比遗传学具有更大的作用。
在癌症中的DNA甲基化
DNA甲基化是一种基因转录的重要的调节器,许多证据已经证实,异常的DNA甲基化与不定期的基因沉默有关,若在启动子区域具有高水平的5-甲基胞嘧啶,将发生基因沉默。DNA甲基化在胚胎发育期间是必需的,在体细胞中,DNA甲基化的方式通常是高保真的传给子细胞。异常的DNA甲基化模式与大量的人类恶性肿瘤有关,并发现其与正常组织相比存在两种不寻常的形式:超甲基化和低甲基化。超甲基化是主要的表征遗传修饰中的一种,其通过肿瘤抑制基因的启动子区抑制转录。超甲基化通常发生在启动子区的CpG岛,且与基因失活有关。整体的低甲基化也通过不同机制与癌症的发生和发展有关。
在癌症中的DNA修复表征遗传学
种系(家族的)突变已在34种导致癌症高风险的不同的DNA修复基因中被确定,包括如BRCA1和ATM。这些被列于“DNA repair-deficiency disorder”一文中。然而,由这样的种系突变导致的癌症仅占癌症中非常小的比例。例如,种系突变仅导致2%到5%的结肠癌病例。 DNA修复基因表达的表征遗传减少,在散发性(非种系)癌症中非常频繁,如在下表中显示的,在一些代表性的散发性癌症中DNA修复基因的突变非常罕见。
表中文献如下: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 DNA修复基因表达不足导致突变率增加。如由于DNA修复基因PMS2, MLH1,MSH2,MSH3或MSH6缺陷或DNA修复基因BRCA2, 或DNA修复基因BRCA2, 错配,小鼠突变率增加,同时注意到在DNA修复基因BLM有缺陷时,人类染色体重排和非整倍性有所增加。 因此,DNA修复缺陷可导致基因组不稳定,且这种基因组不稳定可能是导致癌症的遗传改变的主要潜在原因。实际上,如Nowak等指出的,通过一种数学计算,很多散发性肿瘤的首要事件是一种遗传性改变,其影响遗传不稳定性,并且应注意到DNA修复的表征遗传缺陷是由体细胞遗传的。
癌症中的组蛋白变体H2A
H2A家族的组蛋白变异体在哺乳动物中被高度保存,其通过改变染色质结构在很多调节核内过程中发挥决定性作用。其中一种主要的H2A突变体,H2A.X,标志着DNA损伤,需要补充DNA修复蛋白来促进恢复基因组的完整性。另一种突变体,H2A.Z,在基因活化和抑制中发挥重要作用。在很多癌症中广泛发现有高水平的H2A.Z表达,并且与细胞增殖和基因组不稳定显著相关。 组蛋白变异体macroH2A1在很多类型癌症的发病机理中也很重要,例如肝癌。
癌症治疗
最近的研究已显示,表征遗传药物可替代当前公认的治疗方法,如放射治疗和化学治疗,或作为辅助治疗提高当前疗法的效果。 已证明,原癌基因区的表征遗传控制和肿瘤抑制序列可通过组蛋白构象变化而直接影响癌症的形成和进展。 此外,表征遗传具有可逆性,是其他任何一种癌症治疗法所不能提供的特性。 药物发展主要聚焦于组蛋白乙酰转移酶(HAT)和组蛋白脱乙酰基酶(HDAC),已经上市的新药vorinostat,是一种HDAC抑制剂, 其在口腔鳞状细胞癌的进展中发挥整体作用。 对当前领跑的新药靶点候选者还有组蛋白赖氨酸甲基转移酶(KMT)和蛋白质精氨酸甲基转移酶(PRMT)。
孪生子研究
最近涉及双卵和单卵双胞胎的研究也提供了一些人类表征遗传影响的证据。
微生物中的表征遗传
大肠杆菌
细菌广泛利用DNA甲基化的表征遗传,控制DNA-蛋白的相互作用。细菌利用DNA腺嘌呤甲基化(不是DNA胞核嘧啶甲基化)作为一种表征遗传信号。DNA腺嘌呤甲基化对于细菌在有机体内的毒力很重要,如大肠杆菌,沙门氏菌属,弧菌属,耶尔森氏菌属,嗜血杆菌属和布氏杆菌属。对于甲型变形菌,腺嘌呤甲基化可调节从细胞周期和配对基因转录到DNA复制。对于丙型变形菌,腺嘌呤甲基化为DNA复制,染色体分离,错配修复,噬菌体包装,转座酶活性和基因表达控制提供了信号。 丝状真菌粗糙链孢霉有助于理解胞核嘧啶甲基化在一个突触的模型系统中的控制和功能。在这个有机体内,DNA甲基化抑制转录延伸,与RIP(重复诱导点突变)的基因组防御系统的残余物和沉默基因表达有关。 酵母菌感染性蛋白(PSI)由一种翻译终止因子的某一构象改变而产生,其子细胞可继承这种改变,并在不利条件下提供一种生存优势。这是表征遗传调节使单细胞有机体能够快速对环境应激产生反应的一个范例。朊病毒可被视为能够诱导表型改变而不修饰基因组的表征遗传中介。 用单分子实时排序方法可以在微生物中直接检查表征遗传标志,聚合酶的敏感性允许在测序时测量一个DNA分子的甲基化和其他修饰。 几项研究已经证实,该方法具备在细菌中收集整组基因表征遗传资料的能力。
方式
DNA甲基化(DNA methylation)
基因组印记(genomic imprinting)
母体效应(maternal effects)
基因沉默(gene silencing)
核仁显性
休眠转座子激活
RNA编辑(RNA editing)
参见
B chromosome
Baldwin effect
Behavioral epigenetics
Centromere
Computational epigenetics
DNA demethylation
Dutch famine of 1944(Legacy)
Ecotype
Emergenesis
Epigenetic landscape
Epigenetic theory
Epigenetics in psychology
Epigenomics
Evolutionary capacitance
Evolutionary developmental psychology
Extranuclear inheritance
Histone code
Hologenome theory of evolution
Human genome
Molecular biology
Nutriepigenomics
Position-effect variegation
Preformationism
Somatic epitype
Synthetic genetic array
Weismann barrier
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

- 有价值
- 一般般
- 没价值








24小时热门
推荐阅读

知识互答
关于我们

APP下载


























{{item.time}} {{item.replyListShow ? '收起' : '展开'}}评论 {{curReplyId == item.id ? '取消回复' : '回复'}}