单分子亲核取代反应
机理
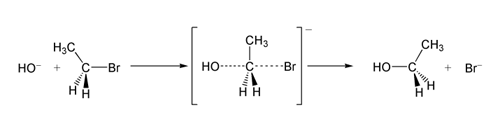
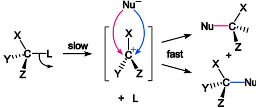
S N 1反应的理想机理可以用以下两步表示:
第一步是底物解离为碳正离子和带负电荷的离去基团,这个过程需要能量,是控制反应速率的一步。第二步是离解出的碳正离子与亲核试剂结合的过程,速率极快。
反应物解离为碳正离子和离去基团总是需要溶剂协助的, 因为R 和X 溶剂化释放出的能量可以大大补偿断裂R-X键所需的能量。如t -BuCl离解生成 t -Bu 和Cl −的反应,气相(无溶剂)时需要630 kJ/mol的能量,因此在非高温下该反应很难发生。但在水中,离解能则只有 20 kJ/mol,即是由于溶剂的缘故。
动力学
由于 S N 1 反应的速控步只涉及一种分子,因此单分子亲核取代反应应为一级反应,并且反应速率也应该只与底物有关。虽然溶剂也协助底物进行第一步解离,但由于溶剂是大量存在的,浓度几乎不变,因此溶剂的浓度不应被包含在速率中。即:
然而上述关系式并不能和所有的实验数据很好吻合,尤其是单分子特征不明显的反应。可以通过考虑第一步的可逆性来修正上述式子,即离解出的 X 与亲核试剂 Y 都可与碳正离子 R 再反应:
反应刚刚开始时,[X] 很小,可以忽略,因此(1)与(2)是相同的。这也是很多 S N 1 反应在开始阶段得到的数据与(1)式吻合得非常好的原因。但随着反应的进行,X 的浓度逐渐增加,(1)式与(2)式的偏差逐渐增大。在溶剂解反应中,[X] 非常大,因此根据(2)式可以得出此类反应速率应当减小的结论。对卤化二芳基甲烷溶剂解反应的研究也证实了这一点。
然而对叔丁基卤的水解反应表明,该 S N 1 反应从始至终非常吻合(1)式。 这可能是由于叔丁基碳正离子不及芳基甲烷类碳正离子稳定,因此对于亲核试剂的“选择性”较差。形象地讲,叔丁基碳正离子生成之后,由于自身不很稳定,它马上会与旁边非常大量存在的亲核试剂 H 2 O 反应并脱去质子生成叔丁醇,而不是“费尽心机”找到一个卤离子再反应,尽管卤离子是比水强得多的亲核试剂。
同离子效应及盐效应也是要考虑的两个因素:
同离子效应:由于 X 的浓度可以影响反应速率,因此可以通过加入与反应物具有相同阴离子的物质来达到减缓反应速率的目的。但这对叔丁基卤的水解反应影响不大。
盐效应:S N 1反应的速率随溶液中离子强度的增大而增大。当 Y 和 RX 都是中性分子时,X 很显然带有负电荷,因而溶液的离子强度将随着反应进行而增大。大多数溶剂解反应即属于上面的类型。因此溶剂解反应的速率很复杂,不仅要考虑解离出的 X 浓度增大对碳正离子 R 的竞争,还要考虑带有负电荷的 X 浓度增大的盐效应,而这两个趋势是相反的。
某些 S N 2 反应为 假一级反应 ,即决定速率的两个因素(Y 和 RX)中有一个物种的浓度几乎保持不变,因此动力学上看反应 像是 降了一级。一般的动力学方法无法区分假一级反应与一级反应。在这种情况下,有时可以用同离子效应来区分这二者,即加入 X。S N 2 反应受同离子效应影响不大,因此反应速率不会发生太大改变,而 S N 1 反应则不同。
检测
某些反应的 S N 1 机理可通过检测其中间体碳正离子来确定,如:
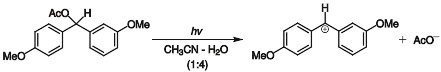
上述反应中的二芳基甲基碳正离子比较稳定,可用紫外光谱检测到。 因此很明显上述反应是 S N 1 机理。
但大多数碳正离子寿命极短,很难用仪器检测出,这时就需要用其他的方法间接证明。例如,在三氟乙酸酯的溶剂解反应 中,如果其为 S N 1 机理,则亲核试剂的种类和浓度对反应速率的影响应当很小,因为反应的速控步与亲核试剂无关。事实上,可通过在不同浓度的含氟离子和二氧化硫的二苯氯甲烷中、吡啶中和三乙胺中的实验结果得知,在修正了盐效应的影响之后,各反应的初速率几乎相等。 这也就证实了上面的假设。
另一种方法则利用了桥环化合物的刚性。由于碳正离子为平面结构,而一些桥环化合物具有较大的刚性,因而 S N 1 反应很难发生在它们的桥头碳上。如 [2.2.1] 环系(降冰片)几乎不能发生桥头碳的单分子亲核取代反应。 再例如,左一的化合物在30%KOH80%乙醇溶液中煮沸21小时,或在与硝酸银乙醇溶液48小时的情况下都不反应, 而相应的直链化合物很快反应。[2.2.2]环系发生 S N 1 反应要比[2.2.1]环系快得多,尽管仍然比不上直链化合物。 SbF 5-SO 2 ClF 溶液中,桥更长的[3.2.2](左二)桥头碳正离子在 -50 °C 以下是稳定的。 右一 和右二 的化合物也可以发生 S N 1 反应。
除此之外,检测是否有重排产物也是确定 S N 1 机理的途径。由于 S N 1 反应涉及碳正离子的生成,而碳正离子的稳定性为 3° > 2° > 1°,因此热力学上不稳定的一级碳正离子总会转变为稳定的三级碳正离子,从而生结构不同的新分子。
离子对
由于碳正离子为平面结构,因此下一步亲核试剂 Y 可以从平面上方或下方进攻,将得到外消旋混合物。但这个特点并不十分明显,只出现在少数单分子特征比较显著的反应中。这可以用 离子对机理 来解释,即:
其中 R X 表示比较紧密的离子对,称作紧密离子对;R || X 表示有溶剂相隔的比较松散的离子对,称为溶剂分离子对;而 R + X 则表示已经解离的有溶剂包围的离子,称为自由离子。S N 1 反应中,亲核试剂 Y 可以于以上可逆过程的任何阶段进攻而发生反应。如 Y 进攻紧密离子对时,碳正离子和离去基团之间联系比较紧密,Y 的进攻带有 S N 2 成分,因此构型翻转;而当 Y 进攻自由离子时,将得到完全消旋的产物;Y 进攻溶剂分离子对的情况则介于这两者之间。离子对理论成功解释了为什么 S N 1 机理得到部分构型翻转的产物或完全消旋的产物。
溶剂解
以溶剂作试剂,底物与溶剂直接发生的反应称为 溶剂解反应 。S N 1 反应也可以是溶剂解反应。
例如叔丁基溴在乙醇中溶剂解生成乙基叔丁基醚的机理为:
溶剂解反应通常速率较慢,因此经常用于研究反应机理。
决定亲核取代反应性质的因素
一般来说,以下因素使化合物容易按 S N 1 机理反应:
生成的碳正离子为 3° > 2° > 1° ;
苯甲型和烯丙型化合物;
离去基团离去能力强;
使用质子溶剂;
使用极性强的溶剂;
以下因素使化合物不容易发生 S N 反应:
乙烯和苯型化合物;
刚性大的桥头碳。
参见
S N 2反应
亲核取代反应
邻基参与效应
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

- 有价值
- 一般般
- 没价值








24小时热门
推荐阅读
知识互答
关于我们

APP下载


























{{item.time}} {{item.replyListShow ? '收起' : '展开'}}评论 {{curReplyId == item.id ? '取消回复' : '回复'}}