



核糖体蛋白质
大肠杆菌的核糖体蛋白质
大肠杆菌细胞的核糖体小亚基中约有22种蛋白质(编号为S1至S22),其核糖体大亚基中约有34种蛋白质(编号为L1至L36)。这些蛋白质是免疫学上独立的蛋白质,只有L7与L12之间表现出相互交叉反应。这些核糖体蛋白质中除S6、L7及L12(等电点约为5)之外全部都是碱性蛋白质(等电点约为10)。此外,除了以下列出的三组例外,其余的核糖体蛋白质都是相互有差异的:
S20与L26被证实是同一种蛋白质,它是唯一一种同时出现在大、小亚基中的蛋白质。
L7与L12分别是同一种蛋白质的N端乙酰化版本及肽链内部甲基化版本。
L8是L7(或L12)与L10的复合物。
另外,已发现L31有两种不同的形态:相对分子质量为7.9 kD的较完整版本及7.0 kD的碎片。 除分子量为61.2 kD的S1外,其余的核糖体蛋白质的分子量都相对集中地分布于4.4 kD至29.7 kD之间。
核糖体小亚基蛋白质的配布情况
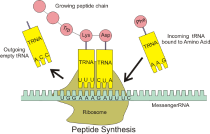
各种核糖体蛋白质在核糖体中的配布情况主要采用重组合技术、化学交联技术、荧光标记技术、免疫电镜法和亲和层析法等技术研究的 。 在大肠杆菌核糖体小亚基(30S)的组装过程中,编号为S4、S7、S8、S15、S17及S20的核糖体蛋白质能直接与16S rRNA结合;在上述第一批蛋白质(统称为“初级结合蛋白”)与rRNA形成复合物后,编号为S5、S6、S9、S12、S13、S16、S18及S19的第二批蛋白质(统称为“次级结合蛋白”)再与之前形成的复合物结合;次级结合蛋白结合后也使最后一批编号为S2、S3、S10、S11、S14及S21的蛋白质(统称为“迟结合蛋白”)的结合更为稳固。蛋白质与螺旋连接处的结合对引发正确的RNA三级折叠与组织核糖体的整体结构至关重要。几乎所有的核糖体蛋白质结构中包含球状结构域和能联络离它们较远的RNA的延伸结构域。 核糖体额外的稳定性来自这些核糖体蛋白质中的碱性官能团对rRNA骨架边缘磷酸基团上相互排斥的负电荷的中和。核糖体蛋白质之间的相互作用(如静电引力及氢键)也有助于维持整个核糖体结构的稳定。
参考文献
De Robertis and De Robertis, Biología Celular y Molecular 10th ed., El Ateneo, Buenos Aires, 1982, ISBN 950-02-0027-9 (in Spanish)
Monika Martick, Lucas H. Horan, Harry F. Noller and William G. Scott. A discontinuous hammerhead ribozyme embedded in a mammalian messenger RNA. doi:10.1038/nature07117, First paragraph | Full Text | PDF
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

- 有价值
- 一般般
- 没价值








24小时热门
推荐阅读

关于我们

APP下载

















