金属羰基配合物
结构及性质
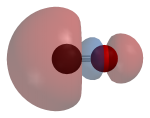
一氧化碳的HOMO是σ分子轨域
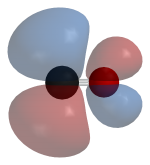
一氧化碳的LUMO是π*反键分子轨域
金属羰基配合物大都难溶于水。例如四羰基镍对水的溶解度只有0.018 g/100 mL(10°C时),不过可溶于大部分的有机溶剂中,也可溶于王水及硝酸。
羰基和金属的键结是反馈π键及σ键的协同成键。碳原子未键结的电子对和金属spd的混成轨域形成σ键,而金属已填满的d轨域和CO配体中的π*反键分子轨域形成二个π键。不过π键的形成条件是金属原子要有d轨域电子,而且金属需要有较低的氧化态(
在羰基金属配合物中,金属和碳原子的距离较短,一般小于1.8 Â,比一般金属和烷基碳之间的距离要少0.2 Â 。
簇合物中的键结模式
在羰基簇合物化学中,羰基配体有许多不同的键结模式 。大部分常见的羰基配体都是端接配体,但羰基也常连接2个或3个金属原子,形成μ 2 或μ 3 的桥接配体)。有时羰基中的碳和氧原子都会参与键结,例如μ 3 -η 就是一个哈普托数为2,连接3个金属原子的桥接配体。
金属中心原子形成反馈π键使M-C键能增强,同时活化了C-O键。
特征
在进行金属羰基配合物的分析时,常会使用红外吸收光谱法。在一氧化碳气体,C-O键的振动(一般以ν CO 表示)出现在光谱中2143 cm 的位置。ν CO 的位置和金属和碳之间键结强度呈现负相关的关系。
除了振动的频率外,频谱中ν CO 的个数也可用来分析配合物的结构,八面体结构旳配合物(如 Cr(CO) 6 ),其频谱只有一个ν CO 。对称性较弱的配合物, 其频谱也会比较复杂,如Fe 2 (CO) 9 的光谱中,CO键的振动频率就出现在2082, 2019, 1829 cm 。
在簇合物中也可以用ν CO 看出CO配基的配位方式。桥接(μ 2 )的羰基配体其ν CO 会比一般端接的羰基配体低100-200 cm 。μ 3 的羰基配体其ν CO 会更低。以下是典型铑簇合物的ν CO :
制备
四羰基镍及五羰基铁可以用将金属直接和一氧化碳反应的方式制备,不过大部分的金属羰基配合物无法直接和类似的方式制备。其他羰基均配物会利用“还原羰化”的方式制备,也就是将金属盐或氧化物在高压反应器中和一氧化碳反应:
若已制备羰基均配物,则可用均配物再进行取代反应或氧化还原反应,制备其他的配合物。
在制备许多锇、铑、钌、铱的混合配体羰基配合物时,会使用二甲基甲酰胺(DMF)或乙二醇单甲醚的溶剂,制备时可以从溶剂中提取羰基,形成配合物。例如沃什卡配合物IrCl(CO)(PPh 3 ) 2 的制备就是将三氯化铱及三苯基膦在沸腾的DMF溶液中反应而成。
自然界的金属羰基配合物
氢化酵素中含有一个有羰基配位的铁原子,羰基使铁原子稳定在低氧化态,以便和氢键结 。在垃圾填埋地中曾检测到痕量的金属羰基配合物,其还原性的环境有助于配合物的合成 。
化合物
大部分的金属羰基配合物都含有不是羰基的配体。例如著名的沃什卡配合物IrCl(CO)(P(C 6 H 5 ) 3 ) 2 及抗震剂三羰甲基环戊二烯锰 (CH 3 C 5 H 4 )Mn(CO) 3 ,但他们的母体化合物结构仍是[M(CO) n ] 。许多金属羰基配合物的化学式依照18电子规则,不过也有例外。
电中性的二元配合物
4族元素有4个价电子,很少形成二元羰基配合物,不过有由Ti(CO) 7 取代而形成的衍生物。
5族元素有5个价电子,因为位阻效应无法形成类似V 2 (CO) 12 有金属及金属键结的羰基配合物,5族元素的羰基配合物有六羰基钒V(CO) 6 ,其价电子只有17个。
6族元素有6个价电子,其羰基配合物包括六羰基铬Cr(CO) 6 、六羰基钼Mo(CO) 6 及六羰基钨W(CO) 6 ,其价电子有6+6x2=18个。
7族元素有7个价电子,其羰基配合物为二聚体,包括十羰基二锰Mn 2 (CO) 10 、Tc 2 (CO) 10 及Re 2 (CO) 10 ,其价电子有7+1+5x2=18个。
8族元素有8个价电子,可形成如五羰基铁Fe(CO) 5 、Ru(CO) 5 及Os(CO) 5 的羰基配合物,其价电子有8+5x2=18个。不过后二个不稳定,容易释放羰基形成十二羰基三钌Ru 3 (CO) 12 及十二羰基三锇Os 3 (CO) 12 。铁的羰基配合物除了五羰基铁外,还有十二羰基三铁Fe 3 (CO) 12 及九羰基二铁Fe 2 (CO) 9 。
9族元素有9个价电子,理论上会形成M 2 (CO) 8 的二聚体羰基配合物,不过此形式的配合物中,只有八羰基二钴Co 2 (CO) 8 稳定,不过其四聚体配合物较为人知,包括Co 4 (CO) 12 、十二羰基四铑Rh 4 (CO) 12 、及十二羰基四铱Ir 4 (CO) 12 ,其价电子有9+3+3x2=18个,铑的配合物还有十六羰基六铑Rh 6 (CO) 16 。其中八羰基二钴很容易和氧气反应,和其他有18个价电子的配合物有不同的特性。
10族元素有10个价电子,羰基配合物有四羰基镍Ni(CO) 4 ,而Pd(CO) 4 及Pt(CO) 4 不稳定。
二元羰基阴离子
4族元素的负二价配合物离子,结构类似6族元素的羰基配合物,如[Ti(CO) 6 ] 。
5族元素的负一价配合物离子,结构也类似6族元素的羰基配合物,如[V(CO) 6 ] 。
7族元素的负一价配合物离子,结构类似8族元素的羰基配合物,如[M(CO) 5 ] (M = Mn, Tc, Re)。
8族元素的负二价配合物离子,结构类似10族元素的羰基配合物,如[M(CO) 4 ] (M = Fe, Ru, Os)。
9族元素的负一价配合物离子,结构类似10族元素的羰基配合物,其中对于[Co(CO) 4 ] 的研究最多。
二元羰基阳离子
7族元素的正一价配合物离子,结构类似6族元素的羰基配合物,如[M(CO) 6 ] (M = Mn, Tc, Re)。
8族元素的正二价配合物离子,结构类似6族元素的羰基配合物,如[M(CO) 6 ] (M = Fe, Ru, Os) 。
金属羰基氢化物
金属羰基配合物的特点之一就是形成负氧化态的金属配合物。其中一些例子在上表中。这些金属羰基氢化物可由质子化相应的阴离子获得。电中性的金属羰基氢化物通常具有挥发性和较强的酸性。
相关的化合物
许多类似羰基的配基也会形成均配物或是混合配体的配合物。
亚硝酰配合物
亚硝酰配合物是指有NO配体的配合物,亚硝酰配合物为数甚多,不过配基只含亚硝酰的二元配合物较少。和羰基相比,亚硝酰基接受电子的能力较强,而异腈基是较好的电子提供者。著名的亚硝酰配合物包括CoNO(CO) 3 和Fe(NO) 2 (CO) 2 。
CS配体配合物
目前已确认有含有CS配体的配合物,但不常见 。其原因有一部分是因为一硫化碳不稳定,容易分解。因此要合成一硫化碳配体的配合物需要透过一些巧妙的途径,例如将四羰基铁酸钠和硫光气反应:
一硒化碳及一碲化碳的配合物非常少见。
PF 3 配合物
三氟化磷配体特性和羰基类似,会形成结构类似的配合物。而膦配体可以取代羰基配合物中的羰基,不过和羰基不同的是,很少形成膦配体的二元配合物。
异腈基配合物
异腈配体可形成许多配合物,其中有些也和羰基配合物有关。典型的异腈基包括甲基异腈MeNC及叔丁基异腈Me 3 CNC。其中一个特别的例子是CF 3 NC,本身是不稳定的化合物,但可以形成稳定的配合物,且性质和羰基配合物相近。
历史
维希·蒙德在1880年代制备了四羰基镍Ni(CO) 4 ,之后其他化学家也制备了结构类似的配合物,包括 瓦尔特·希贝尔 ( 英语 : Walter Hieber ) 制备了第一个金属氢化羰基物 H 2 Fe(CO) 4 及第一个金属卤化羰基物 Fe(CO) 4 I 2 。华特也制备了金属羰基簇合物 Fe 3 (CO) 12 。
金属羰基簇合物可以在羰基化反应(如 Reppe合成法 ( 英语 : Reppe Chemistry ) 、氢甲酰化反应等)中作为触媒,效果相当好,因此也造成这个领域相关研究的成长。
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

- 有价值
- 一般般
- 没价值








24小时热门
推荐阅读
知识互答
关于我们

APP下载
























{{item.time}} {{item.replyListShow ? '收起' : '展开'}}评论 {{curReplyId == item.id ? '取消回复' : '回复'}}