复分解反应
发生条件
碱性氧化物加酸
Na2O + 2HCl → 2NaCl + H2O
Fe2O3 + 6HCl → 2FeCl3 + 3H2O (盐酸除铁锈)
酸加碱
也就是中和反应
NaOH + HCl → NaCl + H2O
酸加盐
2 HCl + CaCO3 → CaCl2 + H2O + CO2↑
碱加盐
2 NaOH + CuSO4 → Na2SO4 + Cu(OH)2
盐加盐
生成物至少有一种沉淀(除非产生气体)
Na2CO3 + CaCl2 → 2 NaCl + CaCO3↓
无机复分解反应
溶液中复分解发生条件:可从设想的生成物而定,如生成物有气体、沉淀、弱电解质、配(络)合物生成时,则复分解反应一般能进行。即有产物脱离体系时,复分解反应一般能进行。
离子反应
例1:HCl(aq) +KOH(aq) →KCl(aq) +H2O(ℓ)
H与OH结合生成弱电解质水,所以反应发生
H + OH → H2O (H3O++ OH → 2 H2O)
K与Cl留在溶液中,所以说生成了KCl与H2O
例2:AgNO3(aq) +HCl(aq) →AgCl(s)↓ +HNO3(aq)
Ag与Cl结合生成的AgCl几乎无法溶于水中,以固体形态存在,所以反应发生
Ag + Cl → AgCl↓
气体生成
例1:H3PO4(aq)+3NaCl(s)→Δ Δ -->3HCl(g)↑ ↑ -->+Na3PO4(aq){\displaystyle {\ce {{H3PO4({\it {aq}})}+3NaCl({\it {s}})->[\Delta ]3HCl({\it {g}})\uparrow +Na3PO4({\it {aq}})}}}
加热,温度升高,沸点低的HCl气体大部分脱离反应体系,反应发生。
例2:CH3COONa(s)+NaOH(s)→Δ Δ -->CH4(g)+Na2CO3(s){\displaystyle {\ce {{CH3COONa({\it {s}})}+NaOH({\it {s}})->[\Delta ]{CH4({\it {g}})}+Na2CO3({\it {s}})}}}
同上
例3:CaCO3(s) + 2HCl(aq) →CaCl2(aq) +H2CO3(aq)
首先通过离子反应生成弱电解质H2CO3(强酸制弱酸,但有例外),由于H2CO3极不稳定,分解产生CO2气体:
H2CO3(aq) →H2O(ℓ) +CO2(g)↑
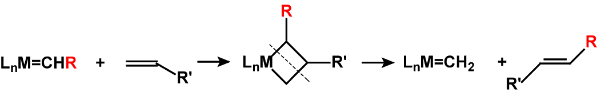
烯烃复分解反应
透过研究金属卡宾在有机化合物生成中所扮演的角式而优化有机化合物的生产过程。由于生产过程中让金属担当催化剂的角色,使这些有机化合物无需要再透过利用卤化过程来达至产品的生成,从而使有机化合物的生产过程可以更环保。伊夫·肖万、罗伯特·格拉布及理查德·施罗克凭这个研究获得2005年度诺贝尔化学奖。
参见
化合反应
分解反应
置换反应
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

- 有价值
- 一般般
- 没价值








关于我们

APP下载