更多文章
更多精彩文章

碰撞学说
碰撞理论,是由德国的Max Trautz及英国的William Lewis 在1916年及1918年分别提出的。
碰撞学说:任何化学反应的发生,必需反应粒子互相接近碰撞,则反应速率与碰撞次数成正比。
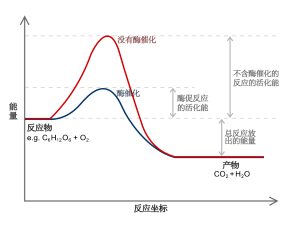
活化能:所谓活化能就是能使粒子发生反应的最低能量。
有效碰撞:所谓有效碰撞是指碰撞的粒子其能量超过活化能,且碰撞方向要正确(发生化学反应所需的能量)
影响反应速率的因素
除了反应物的性质以外,浓度、温度和催化剂也是影响反应速率的重要因素。气体反应的快慢还与压力有关。增加反应物的浓度,即增加了单位体积内活化分子的数目,从而增加了单位时间内反应物分子的有效碰撞的次数,导致反应速率加快。提高反应温度,即增加了活化分子的百分数,也增加了单位时间内反应物分子有效碰撞的次数,导致反应速率加快。使用正催化剂,改变了反应历程,降低了反应所需的活化能,使反应速率加快。在化工生产中,常控制反应条件来加快反应速率,以增加产量。有时也要采取减慢反应速率的措施,以延长产品的使用时间。
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。












{{item.time}} {{item.replyListShow ? '收起' : '展开'}}评论 {{curReplyId == item.id ? '取消回复' : '回复'}}