化学
词源
英语中的“化学”( chemistry )一字的语源有多种说法。一种说法认为是由“炼金术”( alchemy )得名的。英语中“ alchemy ”一词源于古法语的“ alkemie ”和阿拉伯语的“ al-kimia ”,意为“形态变化的学问”( the art of transformation )。阿拉伯语中的“ kimia ”一字则源于希腊语。亦有另一种说法认为英语中的“ chemistry ”一字源自埃及语中的“ kēme ”,意思是“土”( earth )。
在中国,“化学”一词最早出现在1857年墨海书馆出版的期刊《六合丛谈》 。伟烈亚力提及王韬在其日记中记载了从戴德生处听闻的“化学”一词 。一般认为中文中的“化学”一词是徐寿翻译英国人的书《化学鉴原》一书时发明的。
“化学”一词被介绍到日本,取代了原先日语中的译法“舍密” 。
历史

门捷列夫像
人类早期对火的认识
最早的化学要算是人类对火的研究。对于当时的人来说,火可以将一种物体变成另一种物体,所以成为了当时人最有兴趣研究的现象。如果没有火,人类不会发现到铁和玻璃的制造方法。
炼金术
人类发现了黄金这种贵重的金属之后,很多人转移研究怎样把其他物质变成黄金。公元前300年至1500年,炼金术士皆研究如何将一些便宜的金属转化成黄金,因此累积了金属的提取和处理有关的观察和技术。有些炼金术士主要的工作是制造药物,中国当时亦有所谓炼丹术。2000年前,人类已广泛使用金、银、汞、铜、铁和青铜。当时的人类文明,对于陶瓷、染色、酿造、造纸、火药等在工艺方面已有一定成就,在技术经验上,对物质变化的理解已有一定观察和文献累积。
早期化学
早期化学家收集了很多不同物质的资料。在17世纪以前,化学成就并不大(燃素说、炼金术),其中较有成就者如罗伯特·波义耳。到了1750年,化学仍带有神秘色彩,并为不正确的理论支配着。直到1773年,拉瓦锡提出了质量守恒定律,并以氧化还原反应解释燃烧现象,推翻了盛行于中世纪的燃素说,才开启了现代化学之路;他因此被尊崇为“化学之父”。接着道尔顿整合当时的化学知识,并以自身的实验所得提出了划时代的原子说。此后,一些化学家相继发现了各种化学元素,后来门捷列夫建立了元素周期表令化学视界更臻完备。1901年,化学家诺贝尔以其遗产成立了诺贝尔化学奖,以表扬在化学领域对人类有贡献者。
现代化学
现代化学始于20世纪初期蓬勃发展的量子力学。莱纳斯·鲍林引进量子力学解释化学键的本质,得以用波函数的线性叠加来描述。质子、中子和电子的发现,使化学真正由原子尺度来理解化学反应。量子力学和电子学的发展,使得许多新型仪器得以开发,来探索和分析化合物的结构和成分,如光谱仪、色谱仪、核磁共振仪和质谱仪等。
当代化学

移液器,一种生化常用的实验仪器

正在做实验的人
当代化学大致分为四大学门,各学门又有许多延伸的子学门和应用化学领域。
四大学门主要为:
物理化学 是从物理角度分析化学原理的化学学门,可谓近代化学的原理根基。物理化学家关注于分子如何形成结构、动态变化、分子光谱的根本原理,以及平衡态等基本问题,涉及热力学、量子力学、统计力学等重要物理领域。大体而言,物理化学为四大学门中最讲求数值精确以及理论架构严谨的学门。
分析化学 开发分析物质成分、结构与量的方法,使化学物质成分得以定性或定量,化学物质结构得以确定。从分析手段分,分析化学又可分为化学分析和仪器分析。分析化学是化学家最基础的训练之一。化学家在实验技术和基础知识上的训练,皆得力于分析化学。当代分析化学着重仪器分析,常用的仪器分析手段有如下几种:光谱法(例如紫外分光光度法、红外光谱法、原子发射光谱法、原子吸收光谱法、X射线衍射法、拉曼光谱法等)、色谱法(例如薄层色谱法、气相色谱法、液相色谱法、电泳法等)、电化学分析(例如伏安法、电致发光法、电导分析法等)、质谱法、能谱法等。
有机化学 研究碳、氢、氧、氮、硫等元素组成的化合物的化学学门。有机化学主要研究有机化合物的合成途径和方法、机构和物理性质。由于有机化学高度的应用性和悠久的发展历史,通常被普罗大众视为当代化学的代名词。有机合成和新反应途径的开发,对于药物,天然物,生物和材料高分子的开发,都是极为重要的一环,对于化学工业有极大的影响。
无机化学 有机化合物以外元素的化学领域,研究化合物的合成途径和方法,机构和物理性质,最常见的分子体系为金属化合物。有机和无机化学领域常有交叠,甚至有密不可分的趋势。有机金属化学就是一门结合有机和无机领域的化学。
其他延展和应用的学门:
理论化学 从物理的理论去解释各种化学现象的学门。
计算化学 由于分子体系的复杂性,分子的反应,动态,结构,经常是无法完全以量子力学做计算的。因此计算化学提供各种简约的计算方法,来预测并辅助实验结果的推断。实用性上已有诺贝尔奖的肯定,如1998年获诺贝尔化学奖的密度泛函方法。
生物化学 是研究生物体内发生的化学反应和相互作用的学科,被应用于研究细胞中各组分(例如:蛋白质,碳水化合物,脂类,核酸以及其他生物分子)的结构和功能。生物化学被广泛应用于蛋白质各项化学性质的研究,特别是应用于酶促反应的研究。
热化学 是以热力学的观点来研究化学,以焓、熵等状态函数来描述和预言化学物质稳定性和化学反应发生的结果。
电化学 是研究各种因为电推动而发生的化学作用或者会在运作途中产生电力的化学作用的科学学门。生活中常见的各种电池就是电化学的研究成果。
光化学 研究各种化学物质,受到各种频率光线照射之后的化学反应变化。
药物化学 研究化学物质怎样用于药剂中,从而改变药剂的功效,做出医疗的作用。它其实是几个化学门派,包括有机化学、无机化学、生物化学、物理化学,及几个不属于化学的科学学门,包括:药剂学、分子生物学和统计学的结合。
量子化学 用量子力学及其他纯理论手段解释各种化学现象。
核子化学 研究不同的次原子粒子怎样走在一起,形成一个原子核,及研究一个原子核中的物质如何变化。
放射化学 是化学的一个分支,旨在研究那些参与化学反应的物质属于或带有放射性同位素的化学反应的一门学科。例如:采用碘的放射性同位素 I 标记各种蛋白质或激素,以便利用放射免疫分析技术,检测血清标本之中相应物质的浓度。
天体化学 研究外太空的化学物质,分析它们的成分、结构与地球上的物质有什么不同。
大气化学 是一种对地球大气层及其他星球的大气层的研究。大气化学都会研究环境变化途中发生过什么化学反应,是大气科学的一个重要分支学科。
环境化学 从化学角度研究自然环境中生物的变化。
绿色化学 研究怎样从化学角度减低污染。
资讯化学 用电脑去解决化学上的问题。
地球化学 研究地壳中各种物质的化学特性,解释它们的构造。
石油化学 从化学角度研究石油及天然气的特性及炼油技术。
高分子化学 研究比较大的分子,即是高分子,例如发泡胶怎样造出来和有些什么特性。高分子化学亦会研究怎样令很多分子结合为一粒高分子。
超分子化学 研究共价键以外各种化学键,例如:氢键、范德华力、疏水效应的运作。
基本概念
原子
一粒原子是由原子核及外围带负电荷的电子(称为核外电子)组成的粒子,一般而言是化学研究的最小尺度范畴。原子核通常是由质子和中子组成。与通常的物理概念不同的是,单一的质子在化学领域被认为是 H(氕)原子核,也就是说原子核内必然含有质子,但可能不含中子。 电子带负电荷,质子带正电荷,个数相同使得电荷平衡,令整个原子呈电中性。当核外电子数与原子核内质子数不相同时,则形成离子。通常认为离子也是原子的一种。
氦原子的结构示意图
元素
拥有相同质子数的同一类原子被称为“元素”。例如,氢这种元素中所有原子都是只有一粒质子。这个概念换过来说亦可:所有原子核中有六粒质子的原子都是碳,所有原子核中有九十二粒质子的都是铀。元素亦有另一定义,就是所有不可以用化学方法分解的物质都是元素。
在这么多种列举元素的方法中,最常用和最方便的莫过于元素周期表。周期表根据原子序数来排列原子,而原子序数就是一粒原子中质子的数量。因为这个奇怪的排列,排在一起的元素,无论是同一个直行、同一个横行还是纯粹在附近,都有一些大致上固定的关系。
同一种元素可能有很多个不同的核素。它们的质子数相同而中子数不同,因而化学性质相同。但由于它们的中子数不同,造成原子核稳定性不同,而造成某些核素具备放射性。同一种元素的不同核素在元素周期表内占据同一个位置,因此同一种元素的不同核素互称同位素。例如 H(氕)与 H(氘)互称同位素。
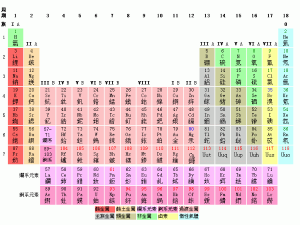
元素周期表
物质
化学物质是指一种物体,它既确定了其化学组成,也确定了它的化学性质 。严格的来讲,混合的化合物,元素等都不能算是化学物质,只能说是化学药品或者说化学制品。大多数我们日常生活碰到的化学品都是混合物,比如空气、合金、生物制品。
命名法
物质的命名法在化学语言当中是最严格的一环。早在很久以前,化合物的命名是由其发现者自行决定的,这样则导致了命名的困难和混乱。而现在我们最常用的还是国际纯粹与应用化合会( International Union of Pure and Applied Chemistry ) ( IUPAC )命名方法。它用一个命名系统让所有的化合物都有一个独有的名称和代码。有机化合物通过有机命名 系统命名;而无机化合物通过无机命名 系统命名。而通过化学索引服务( Chemical Abstracts Service ),我们可以轻松的通过CAS号( CAS registry number )来找到每一个化合物的性质、特性、命名和结构。
分子
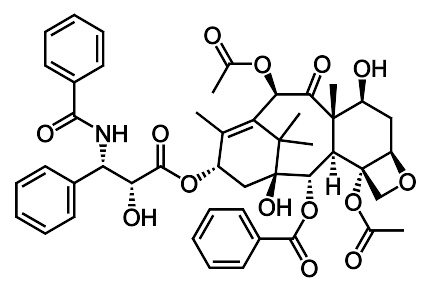
一个分子结构式描述了化学键以及它在分之中所连接的原子的位置,图上为紫杉醇的分子结构
一个分子是化合物的最基本结构,不用化学方法是拆不开的。大部分分子都是由两个或以上原子组成,但是都有些特例,例如氦气分子,只有一个原子。这些原子,如果多于一个,是通过化学键结合。
离子和盐
离子是带电荷的物质,可以由原子或分子失去或得到电子形成。正离子(例如钠离子Na )和负离子(例如氯离子Cl )结合可以成为电荷中性的盐(例如食盐NaCl)。有些离子是由几个原子组成,而它们进行化学作用的时候又不会分离,例如磷酸根离子(PO 4 )、铵离子(NH 4 )。气相的离子通常被称为等离子体。
酸碱性
物质可以被分类为一种酸或者是一种碱。通常我们有几种进行酸碱分类定义的理论。其中最简单的要数阿累尼乌斯理论( Arrhenius theory ),它认为:酸是能够在水当中电离出水合氢离子的物质;而相反碱则是在水当中电离出氢氧根离子的物质。而酸碱质子理论( Brønsted–Lowry acid-base theory )则认为酸是能够在化学反应中给其他物质氢离子的物质;而碱则是相应能得到氢离子的物质。第三种理论被称作是路易斯酸碱理论( Lewis acid-base theory ),它是基于形成化学键之上的。路易斯理论认为:酸是在键的形成当中接受了一对电子;而碱则是在形成键的过程中给予了其他物质一对电子。因此,一个物质如果对于不同的酸碱理论来说,可能在此是酸,在另外一个理论来说却是碱。
酸性强度的衡量方法主要有两种:第一种是阿累尼乌斯定义的也就是我们最常用的pH,它是通过衡量一个溶液当中氢离子的浓度来确定酸性的大小。它的计算方法是pH=-log 10 [H ],也就是pH等于氢离子浓度的负对数(以10为底)。因此可以说,拥有更高浓度的氢离子溶液,其pH越低而酸性更强。第二种是 Brønsted–Lowry 定义,也就是酸解离常数(K a ),它衡量的是物质作为酸的时候给予氢离子的能力。因此一个酸性越强的物质,其K a 更高,更具有给予氢离子的的倾向。同样的我们可以用pOH代替pH, K b 代替K a 来说明碱性强度。
氧化还原
氧化还原的概念和一个物质的原子获取或者给予电子的能力有关。物质拥有氧化其他物质的能力就被成为氧化性,而此物质被成为氧化剂( oxidizing agents ),或者成为氧化物。一个氧化剂能够将电子从其他的物质上移走。相应的,具有还原其他物质的物质被称作有还原性而成为还原剂( reducing agents )或者成为还原物。一个还原试剂能够传递给其他物质电子并且氧化自身。而正因为其“给予”了其他物质电子,它还被称为供电子物。氧化还原的性质与氧化数( oxidation number )有关--其实真正的给予或者获取完成的电子并不存在。所以,氧化过程被定义为增加了氧化数,而还原则是降低的氧化数。
化学品
化学品泛指一切有确实化学构造及化学成分的物质,所以又称化学物质。它们可以是元素、化合物或混合物。日常生活中,我们会遇到的东西多数都是混合物,例如合金。
化合物

一颗氯化钠(食盐)的结晶
化合物是一些以不同元素用固定比例结合而成的物质。成分的比例决定了它的化学特性。例如水是用氢同氧以二比一组合而成,组成水分子的三个原子之间构成了104.5度的健角。不同化合物及元素之间的变化称为化学反应。
摩尔以及物质的量
摩尔 ( 英语: mole )是物质的量的国际单位,符号为 mol 。1摩尔是所含基本微粒个数与12克的碳-12( 6 12 C {\displaystyle {}_{6}^{12}\!{\mbox{C}}} )中所含原子个数相等的一系统物质的量。使用摩尔时,应指明基本微粒,可以是分子、原子、离子、电子或其他基本微粒,也可以是基本微粒的特定组合体。1摩尔物质中所含基本微粒的个数等于阿伏伽德罗常数,符号为N A ,数值约是6.0221367×10 ,常取6.02×10 。
一种物质的摩尔质量与分子量,在使用国际单位制时, 在数值上 相等。
化学键

原子电子以及分子轨道
化学键是指组成分子或材料的粒子之间互相作用的力量,其中粒子可以是原子、离子或是分子。化学键的物理本质来自于粒子和粒子之间的静电力,量子力学上意指原子间电子的波函数线性叠加。化学键是化学最重要的概念之一,物理理论本质由莱纳斯·鲍林建立。化学家为能简洁表述化学键并规避量子力学的复杂性,将化学键分类为共价键、离子键和金属键,较弱的键结如氢键及较特殊的配位相互作用等。无论分类为何,其物理本质都是相同的。
分子间力
分子间力是不同分子之间的作用力,主要有氢键,范德华力,亲水作用/疏水作用等,这种作用力比化学键弱,容易打开或重新组合,但是是形成分子空间排列和架构的重要作用力,是现代化学的重要研究方向之一。
物理特性

水涌上沙滩造成浪,就是水与沙的物理特性
物质有时会是液体,有时会是固体,有时会是气体,这些叫作物质的相态。一件物质是否软、透不透光、透光的话它的折射率是多少,这些都是一件物质的物理特性。总而言之,物理特性即是一种物质不靠化学作用都可以断定到的特性。
化学反应

氯化氢同氨发生化学反应生成氯化铵
化学反应,亦称化学变化是一种物质转变为另一种物质的过程,涉及分子中原子的交换和化学键的转移、形成或消失。化学反应形成的改变既可令很多独立的分子结合,也可将一个较大型的分子拆开成为很多独立的小分子,甚至是同一分子内有原子移动,即使原子的数量没有改变,但仍会构成化学反应。
平衡
能量
化学定律
化学反应的守恒必须符合物理守恒定律,反应前后应符合:
质量守恒定律:一个化学反应发生,物质的总质量不会有任何变化。
能量守恒定律:化学反应所产生的能量总和不变,只是能量形式依照反应模式而变化。引出三个重要概念:平衡,热力学,动力学。
电荷守恒定律:化学反应前后的电荷数应守恒。
阿伏伽德罗定律
比尔-朗伯定律
波义耳定律(1662年,压力和体积相关)
查理定律(1787年,体积和温度相关)
斐克扩散定律
盖吕萨克定律(1809年,压力与温度相关)
亨利定律
盖斯定律
定比定律
倍比定律
拉乌尔定律:理想溶液在一固定温度下,其内每一组元的蒸气分压与溶液内各该组元的摩尔分数成正比,其比例系数等于各该组元在纯态下的蒸气压。(物理化学的基本定律之一)
化学工业
化学工业(化工)是当代经济活动当中重要的一部分。全球50大化学品制造商在2004年共销售了5870亿美元的业绩,其中利润占据了8.1%,其中研发成本占据了2.1%
学科分类
无机化学是研究无机化合物的化学。
有机化学是研究有机化合物的结构、性质、制备的学科,又称为碳化合物的化学。
分析化学是开发分析物质成分、结构与量的方法,使化学物质成分得以定性或定量,化学物质结构得以确定。
生物化学是研究生物体中的化学进程的一门学科,常常被简称为生化。
材料化学(材料科学或材料工程)是一个多学科领域,涉及物质的性质及其在各个科学和工程领域的应用。它是研究材料的制备或加工工艺、材料的微观结构与材料宏观性能三者之间的相互关系的科学。
核化学又称为核子化学,研究原子核(稳定性和放射性)的反应、性质、结构、分离、鉴定等的一门学科。
物理化学是一门从物理学角度分析物质体系化学行为的原理、规律和方法的学科,可谓近代化学的原理根基。
理论化用非实验的推算来解释或预测化合物的各种现象。近年来,理论化学主要包括量子化学,即应用量子力学来解决化学问题。
结构化学是研究原子、分子和晶体结构以及结构与性能之间关系的学科。近几十年,这门学科获得迅速发展,结构化学观点不仅渗透到化学各个分支学科领域,同时在生物、材料、矿冶、地质等技术科学中也得到应用
其他还有诸如放射分析化学、同位素化学、辐射化学、核燃料、反应堆和裂变产物化学、、地球化学、海洋化学、大气化学、环境化学、宇宙化学、星际化学、药物化学、神经化学、农业化学、石油化学、木材化学、土壤化学、煤化学、食品化学、化学地理学、天体化学、岩石化学、空间化学、胶体与界面化学等
参见
诺贝尔化学奖
元素列表
化学工业
化学物质列表
化学术语列表
化学反应方程式列表
元素周期表
化学家
同位素列表
化学基本主题列表
化学与物理学的比较
注释及参考资料
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

相关资料

- 有价值
- 一般般
- 没价值








24小时热门
推荐阅读
知识互答
关于我们

APP下载




























{{item.time}} {{item.replyListShow ? '收起' : '展开'}}评论 {{curReplyId == item.id ? '取消回复' : '回复'}}