朱利亚烯烃合成
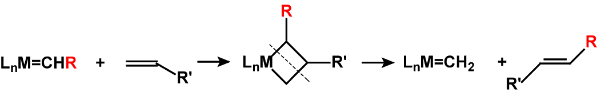
反应机理
砜的α-氢具有酸性,在强碱(如正丁基锂、叔丁基锂、甲基锂、二异丙基氨基锂)的作用下失去,得到负离子2,与醛发生加成,生成负离子中间体3。接着3与R3-X反应成酯,经钠汞齐在极性质子溶剂(如甲醇、乙醇)中还原消除,经过自由基机理,生成烯烃6。
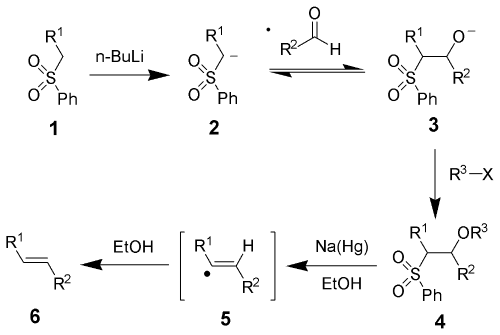
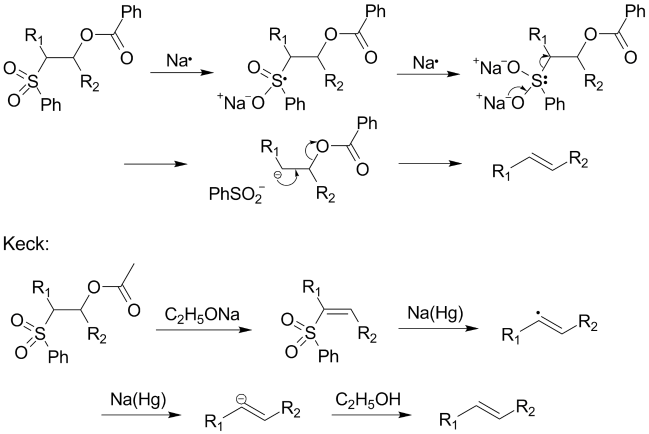
还原消除一步的详细机理还不是很明确,以前认为是下图中的第一个机理,但1995年时Keck等人发现,如果反应在氘代溶剂中进行,则砜的α-氢几乎被完全氘代,与原来假设的机理不符,故提出了一个新的机理(下图中的第二个机理)。烯烃的立体化学与中间体4无关,无论是苏式还是赤式的反应物经过反应后,都得到反式烯烃。这可能是由于还原时生成的烯基自由基可以自由旋转,从而偏向于热力学稳定产物的缘故。若用二碘化钐作还原剂,反应的立体选择性(E/Z值)明显下降,而且没有上述的氘代现象发生。Keck等人认为其原因是砜基离去后,生成的碳负离子不够稳定,很快就发生消除生成烯烃,而没有时间达到平衡的缘故。
杂环芳香化合物
当把原料中的苯基砜换为杂环芳基砜时,反应机理会发生很大变化。 以常见的苯并噻唑基砜为例, 砜被去质子化,然后与醛发生加成生成负离子2。之后2发生Smiles重排反应, 经过加成-消除两步后,与芳环相连的原子变为氧,涉及的不稳定中间体很快放出二氧化硫,生成羟基苯并噻唑锂盐和烯烃。由于反应不再涉及可以发生平衡反应的中间体(如碳负离子),故烯烃的立体化学由砜负离子与醛加成一步的立体选择性所决定,一般都是立体异构体的混合物。
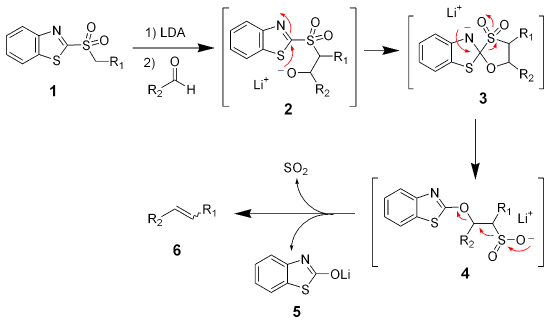
Julia-Kocienski烯烃合成
发生Julia反应的砜为四唑基砜时,反应与上面苯并噻唑基砜的机理相同,称为Julia-Kocienski烯烃合成,示例如下。

参见
Horner-Wadsworth-Emmons反应
Johnson烯烃合成
Peterson烯烃合成
Wittig反应
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

- 有价值
- 一般般
- 没价值








24小时热门
推荐阅读

关于我们

APP下载
























{{item.time}} {{item.replyListShow ? '收起' : '展开'}}评论 {{curReplyId == item.id ? '取消回复' : '回复'}}