共振
简介
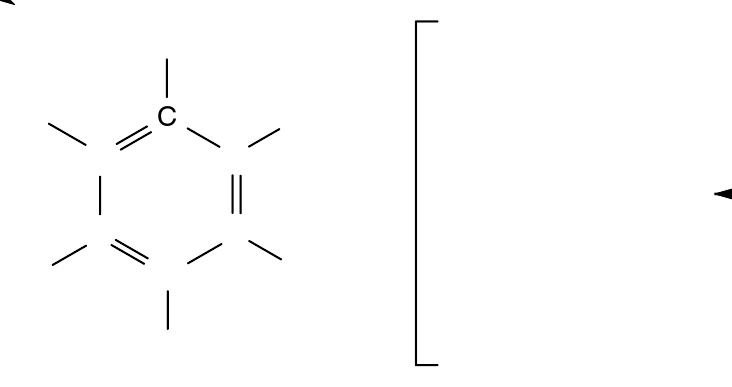
苯的共振式
单一路易斯结构中,共价键的键级只能是整数,常与实验数据或量子力学计算所得的结果不符。共振论认为,如果一个物质存在两种以上满足共振要求的路易斯结构,这类物质只能用共振式来书写,而且它们实际上综合具有这些结构的特点。每一个共振中的结构称为共振结构或极限结构,而这样的物质看作由共振结构“杂化”而成,称为杂化体。共振结构之间以双向箭头连接。根据情况不同,每一个共振结构对杂化体的贡献程度不同。
以右图中的苯为例。根据价键理论,可以写出两种不同的苯分子结构。但是实验表明,苯分子中的C-C键长相等,处于单键和双键之间,与单一的路易斯结构相矛盾。为了解释这个现象,共振论认为苯实际上是这两种结构的杂化体,两种极限结构贡献相等,因此苯的六个碳完全等同。
需要注意的是,每个极限结构实质上并不存在,杂化体具有单一特定的结构,也并不是极限结构的混合物或平衡体系。只是任何一个路易斯结构都无法准确地表达物质的结构,只有用极限结构杂化的思想来表达才更加确切。因此共振式与互变异构是截然不同的两个概念,互变异构涉及原子位置的改变,而共振式则不然。
以矢量作比喻
共振式中各共振结构的关系可以与正交坐标系中的矢量坐标类比。假设矢量r可以写作xi + yj + zk(x, y, z是分矢量,i, j, k为坐标轴),那么r不是i、j或k中的任意一个,而是它们的特定组合,杂化体也是如此。三个并不存在的共振结构x、y和z,都对杂化体有贡献,而且贡献不同,它们的引入,可以在很大程度上方便理解分析杂化体的结构及性质。
本质
除了从路易斯结构图上理解物质结构外,共振论还有利于从数学层面上理解价键理论(VB)。当某物质的性质无法用一个价键结构来描述时,即无法以激发、杂化和成键的过程解释,那么共振论的概念便被引入,以便于理解结构。
再次以苯为例。价键理论中,先写出苯分子两种可能的路易斯结构,然后这两种结构线性组合,形成的波函数中含有两种结构各一半的贡献。然而,大多数情况下极限结构的贡献并不相等,这时可通过变分最优化先求得波函数的最低能量,作为最佳近似值得到贡献的系数,再由此近似估计分子的真实结构。
在更复杂的分子轨道理论中,共振通常是π轨道中电子离域的同义词。比如苯分子中,分子轨道示意图表明6个π电子离域在6个碳原子上,碳-碳键键级超过单键,整个分子以正六边形环外加中心的圆来表示更加妥当。一般教学中,常混合价键理论和分子轨道理论的思想,认为C-C之间不只存在σ键,而且还包括π电子的离域。
共振能
杂化体的能量总是低于各极限结构,常用共振能的概念来表示该降低值。它被定义为杂化体能量低于最稳定极限结构能量的数值,常与另一个概念离域能混用。电子的离域降低了轨道能,增加了分子的稳定性,常会造成分子的芳香性,如苯。
共振能随着极限结构数的增多而增大,尤其是存在等价极限结构时(能量相等)。可由量子化学计算、热化学方法或分子的氢化热来估计共振能。例如,氢化苯的一个双键约需120kJ/mol的能量,乘以3得到苯的完全氢化需要的能量,大概为360kJ/mol。实验测得苯的氢化热只有210kJ/mol,因此,共振能便是剩下的150kJ/mol。
共振能可用于计算鲍林标度下的电负性。
共振式
书写共振式时必须遵守以下两点:
所有的极限式必须符合路易斯结构式。
同一分子的极限式中原子排列顺序、未成对电子数、总电子数和电荷数必须相同。
不同极限结构的稳定性可通过以下规则判断:
极限结构的电荷越分散越稳定;
满壳层的结构比价电子层不满的结构稳定;
负电荷处在电负性强原子上的极限结构更稳定,正电荷处在电负性弱原子上的极限结构更稳定;
具有不满壳层且带电荷原子的极限结构不稳定;
极限结构含有的共价键数目越多越稳定;
正负电荷分离越远越不稳定,同号电荷越近越不稳定;
键长、键角有改变的极限结构不稳定。
极限结构对杂化体的贡献中,越稳定的极限结构对杂化体贡献越大,因此真实分子的性质很大程度上依赖于贡献大的结构。此外,由等价极限结构构成的体系更加稳定,如烯丙基正离子(见下)。
历史
共振的概念首先由莱纳斯·鲍林在1928年提出,“共振”一词(Resonance)来源于用量子力学法处理H2时,产生的两个耦合振子的经典系统。30年代时,英果尔德表示,用“中介”来描述共振论更加恰当。德国化学家阿恩特(阿恩特-艾斯特尔特合成的发现者之一)首先引入共振式中的双向箭头。
40年代起,由于意识形态的不同,苏联科学界开始了一场对“资产阶级科学”的批判。当时批判的主要对象有:生物学中摩尔根的基因论、物理学中的“量子力学唯心理论”、化学中鲍林的共振论及工程学中维纳的控制论等,批判的高潮阶段为1951年苏联科学院化学部的“有机化学中化学结构理论问题讨论会”。
共振论中的“共振”与物理学中传统的共振概念有很大差异,曾有人建议将共振改为“离域”,相应的共振能则变为“离域能”,共振结构变为“极限结构”或“贡献结构”。
例子

臭氧、苯和烯丙基阳离子的共振式
画简单分子的极限结构时,可以遵循以下的方法:
数出总价电子数
画出键连顺序,先假设所有键都为单键
依照八隅体规则为周边原子补充电子
将总价电子数中剩下的电子分配到中心原子上,若不满足八隅律,则:
在一个键中加入多重键(双键、叁键),直至满足八隅律——画出一个极限结构
将多重键应用到其他键中,画出其他极限结构
活性中间体
碳正离子和自由基等活性中间体常会因为电子离域,而生成意料之外的产物。例如在烯丙基重排中,当1,3-丁二烯与等物质的量的HCl混合时,除了生成应当得到的3-氯-1-丁烯外,还检测到了1-氯-2-丁烯。进一步的同位素标记实验表明,反应中发生了双键从1,2-位向2,3-位的转移。连同超强酸溶液中的NMR数据,可以得出,中间体烯丙基碳正离子与经典的碳正离子不同,必定含有高度离域的结构。该离子的共振式见上图。
不稳定分子的离域程度通常较大,共轭双烯的激发态由于共轭更加稳定,也因此用作有机染料。
不含π电子的电子离域,即超共轭,存在于非经典的降樟基正离子、乙硼烷和甲鎓离子(CH5)中,也称作三中心两电子键。它们的共振式涉及σ电子的重排。
不足
虽然共振论为价键理论补充了内容,对一些实验事实做出了很好的解释,但对于立体化学以及反应中的激发态等问题,共振论仍为力,在某些方面作出的预测甚至是错误的。由于其任意性,在选择极限结构时,许多激发态的结构常因不符合规定而被忽略掉,在某些情况下,这是错误的。此外,也可以由“极限结构越多分子越稳定”的规定引出一些与事实不符的结论。
参见
离域
共轭系统
超共轭效应
芳香性
互变异构
共振积分
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

- 有价值
- 一般般
- 没价值








24小时热门
推荐阅读


关于我们

APP下载



























{{item.time}} {{item.replyListShow ? '收起' : '展开'}}评论 {{curReplyId == item.id ? '取消回复' : '回复'}}