磷酸盐
化学特性
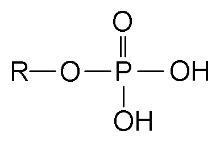
在酸性溶液下磷酸官能团的结构式。在碱性的溶液下,该官能团会释放两个氢原子,并离化磷酸盐带有-2的形式电荷。
磷酸盐离子是一个多原子的离子,其实验式是PO4,而分子量是94.97。它包含一个磷原子,并由四个氧原子所包围,形成一个正四面体。磷酸盐离子带有-3的形式电荷,且是磷酸氢盐离子(HPO4)的共轭碱;磷酸氢盐离子则是磷酸二氢盐离子(H2PO4)的共轭碱;而磷酸二氢盐离子又是磷酸(H3PO4)的共轭碱。它是一个超价分子(磷原子在其价壳层有着10个电子)。如果磷酸盐作为一种有机磷化合物就被称为磷酸酯,其化学式为OP(OR)3。
除了一些碱金属外,大部分磷酸盐,在标准状态下,都是不可溶于水的。
在稀释的水溶液中,磷酸盐以四种形式存在。在强碱环境下,磷酸盐离子(PO4)会较多;而在弱碱的环境下,磷酸氢盐离子(HPO4)则较多。在弱酸的环境下,磷酸二氢盐离子(H2PO4)较为普遍;而在强酸的环境下,则水溶的磷酸(H3PO4)是主要存在的形式。更精确的就是以下三种平衡反应:
在25℃的环境下有以各种不同的酸度系数(mol/L):
若在强碱的pH值下(pH=13),可以发现:
[H2PO4− − -->][H3PO4]≃ ≃ -->7.5× × -->1010 , [HPO42− − -->][H2PO4− − -->]≃ ≃ -->6.2× × -->105 , [PO43− − -->][HPO42− − -->]≃ ≃ -->2.14{\displaystyle {\frac {[H_{2}PO_{4}^{-}]}{[H_{3}PO_{4}]}}\simeq 7.5\times 10^{10}{\mbox{ , }}{\frac {[HPO_{4}^{2-}]}{[H_{2}PO_{4}^{-}]}}\simeq 6.2\times 10^{5}{\mbox{ , }}{\frac {[PO_{4}^{3-}]}{[HPO_{4}^{2-}]}}\simeq 2.14}
可见只有磷酸盐(PO4)及磷酸氢盐(HPO4)是主要的成分。
若在中和的pH值下(例如原生质,pH=7.0),可以发现:
[H2PO4− − -->][H3PO4]≃ ≃ -->7.5× × -->104 , [HPO42− − -->][H2PO4− − -->]≃ ≃ -->0.62 , [PO43− − -->][HPO42− − -->]≃ ≃ -->2.14× × -->10− − -->6{\displaystyle {\frac {[H_{2}PO_{4}^{-}]}{[H_{3}PO_{4}]}}\simeq 7.5\times 10^{4}{\mbox{ , }}{\frac {[HPO_{4}^{2-}]}{[H_{2}PO_{4}^{-}]}}\simeq 0.62{\mbox{ , }}{\frac {[PO_{4}^{3-}]}{[HPO_{4}^{2-}]}}\simeq 2.14\times 10^{-6}}
所以只有磷酸二氢盐(H2PO4)及磷酸氢盐(HPO4)离子是主要成分(当中62%是H2PO4,38%是HPO4)。需要留意的是在细胞外体液(其pH约为7.4),这个比例会倒转(61%是HPO4,39%是H2PO4)。
若在强酸的pH值下(pH=1),可以发现:
[H2PO4− − -->][H3PO4]≃ ≃ -->0.075 , [HPO42− − -->][H2PO4− − -->]≃ ≃ -->6.2× × -->10− − -->7 , [PO43− − -->][HPO42− − -->]≃ ≃ -->2.14× × -->10− − -->12{\displaystyle {\frac {[H_{2}PO_{4}^{-}]}{[H_{3}PO_{4}]}}\simeq 0.075{\mbox{ , }}{\frac {[HPO_{4}^{2-}]}{[H_{2}PO_{4}^{-}]}}\simeq 6.2\times 10^{-7}{\mbox{ , }}{\frac {[PO_{4}^{3-}]}{[HPO_{4}^{2-}]}}\simeq 2.14\times 10^{-12}}
可见H3PO4,相较于H2PO4是最多的。实际上HPO4及PO4会接近消失。
磷酸盐可以形成聚合离子的二磷酸盐(亦即焦磷酸盐,P2O7)、三磷酸盐(P3O10)等。多种的偏磷酸盐离子都有着一个实验式的PO3,且是在普遍在多种化合物。
磷酸盐矿产可以包含大量自然产生的铀。若吸收了这些土壤改良剂可以引致农作物含有铀成分。
出现

磷酸石样本
磷酸盐是元素磷自然产生的形态,在多种磷酸盐矿物中可以找到。元素的磷或是磷化物是很难发现的(只有极少量在陨石中可以找到)。在矿物学及地质学,磷酸盐是指含有磷酸盐离子的石或矿石。
在北美洲最大型的磷矿粉矿床位于美国的佛罗里达州中部、爱德荷州的索达斯普陵、北卡罗莱那州沿岸区域。而其次的是位于蒙大拿州、田纳西州、乔治亚州及南卡罗莱那州近查尔斯顿。瑙鲁这个细少的岛国就曾经是有着大量高质素的磷酸盐矿产,但现时已被大量挖掘。磷矿粉亦可以在纳弗沙岛、摩洛哥、突尼斯、以色列、多哥及约旦找到,这些地方亦有大量的磷酸盐矿业。
在生物中,磷是以溶液中游离的磷酸盐离子的形态出现,称为“无机磷酸盐”,这是要与其他在磷酸酯中的磷酸盐作出区别的。无机磷酸盐是会以Pi来表示,它可以是由焦磷酸盐(以PPi来表示)水解而得:
但是,磷酸盐最普遍是以一磷酸腺苷(AMP)、二磷酸腺苷(ADP)、三磷酸腺苷(ATP)、脱氧核糖核酸(DNA)及核糖核酸(RNA)的形式出现,且可以经由水解ADP或ATP而被释放出来。对于其他的二磷或三磷核苷亦有相似的反应。在ADP及ATP,或其他二磷及三磷核苷中的磷酸酐键,包含着大量的能量,所以它们在生物中有着重要的地位。它们一般会被称为高能磷酸磷,就像在肌肉组织中的磷酸肌酸一样。一些如膦的化合物在有机化学上亦会被使用,但它却似乎没有自然的相应物。
由于磷酸盐对生物的重要性,所以在生态学上,它是高度被采集。因此,它在环境中往往是限量试剂,而它的可得性则决定生物成长的速度。将大量的磷酸盐加入缺乏磷酸盐的环境或微生物环境中,会对生态有着重大的影响。例如,某一种生物的暴涨会使其他生物死亡。另外耗氧的种群也会消亡(参见富营养化)。在污染的问题下,磷酸盐是总溶解固体量(一种主要的水质指标)的主要成分。
用途
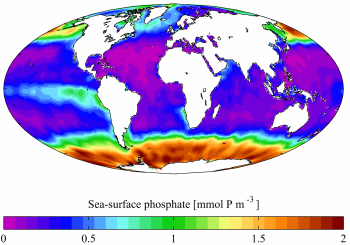
每年平均海水表面的磷酸盐浓度
磷酸盐一般会用在清洁剂中作为软水剂,但是因为藻类的繁荣衰退周期会影响磷酸盐在分水岭的排放,所以在某些地区磷酸盐清洁剂是受到管制的。
在农业上,磷酸盐是植物的三种主要养份之一,且是肥料的主要成分。磷矿粉是从沉积岩的磷层中开采。以前它在开采后不用加工便可使用,但现时未加工的磷酸盐只会用在有机耕种上。一般它都是会化学加工制成过磷酸石灰、重过磷酸钙或磷酸二氢铵,它们的浓度都较磷酸盐高,且较易溶于水,所以植物可以较快吸收。
肥料级数一般有三个数字:第一个是指氮的数量,第二个是指磷酸盐的数量(以P2O5作基准),而第三个是指碱水(以K2O作基准)。所以一个10-10-10的肥料就每种成分各有10%,而其他的则是填充物。
从过度施肥的农地迳流的磷酸盐会是富营养化、赤潮及其后缺氧的起因。这就像磷酸盐清洁剂一样会引起鱼类及其他水中生物的缺氧症。
参见
有机磷化合物
膦(PR3)
氧化膦(OPR3)
亚磷酸盐(P(OR)3)
次亚膦酸盐(OP(OR)R2)
膦酸盐(OP(OR)2R)
延伸阅读
Schmittner Karl-Erich; Giresse Pierre. Micro-environmental controls on biomineralization: superficial processes of apatite and calcite precipitation in Quaternary soils. Sedimentology (Roussillon, France). 1999, 46 (3): 463–476.
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

- 有价值
- 一般般
- 没价值








24小时热门
推荐阅读
知识互答
关于我们

APP下载


























{{item.time}} {{item.replyListShow ? '收起' : '展开'}}评论 {{curReplyId == item.id ? '取消回复' : '回复'}}