



傅-克反应
傅-克烷基化反应
傅-克烷基化反应在强路易斯酸的催化下使用卤代烃对一个芳环进行烷基化。假设使用无水氯化铁作为催化剂,在氯化铁的作用下,卤代物产生碳正离子,碳正离子进攻苯环并取代环上的氢,最后产生烷基芳香族化合物和氯化氢。总反应式如下:
这类反应有个严重缺点:由于烷基侧链的供电性,反应产物比起原料具有更高的亲核性,于是产物苯环上的另一个氢继续被烷基所取代,导致了过烷基化现象而形成了众多副产物。由于这类反应是可逆的,还可能出现烷基被其他基团所取代的副产物(例如被氢取代时,也称为傅-克脱烷基化反应);另外长时间的反应也会导致基团的移位,通常是转移至空间位阻较小、热力学稳定的间位产物。另外如果氯不是处于三级碳原子(叔碳原子)上,还有可能发生碳正离子重排反应,而这取决于碳正离子的稳定性:即三级碳>二级碳>一级碳。 空间位阻效应可以被利用于限制烷基化的数量,比如1,4-二甲氧基苯的叔丁基化反应。
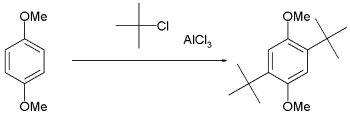
1,4-二甲氧基苯的叔丁基化
烷基化的底物并不局限于卤代烃类,傅-克烷基化可以使用任何的碳正离子中间体参与反应,如一些烯烃,质子酸,路易斯酸,烯酮,环氧化合物的衍生物。如合成1-氯-2-甲基-2-苯基丙烷就可以从苯与3-氯-2-甲基丙烯进行反应:
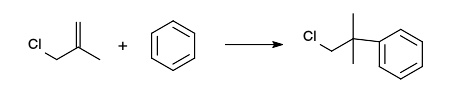
1-氯-2-甲基-2-苯基丙烷的合成
曾有研究实例表明亲电试剂还能选用由烯烃和NBS生成的溴离子。
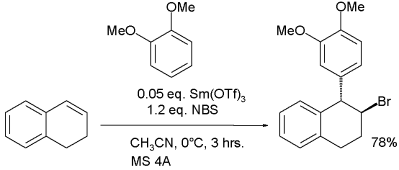
通过烯烃的傅-克烷基化
在这个反应中三氟甲磺酸钐被认为在卤离子形成中活化了NBS的供卤素能力。
傅-克去烷基化反应
傅-克烷基化是一个可逆反应。在 逆向傅-克反应或者称之为傅-克去烷基化反应当中烷基可以在质子或者路易斯酸的存在下去除。
例如,在用溴乙烷对苯的多重取代当中,由于烷基是一个活化基团,原来期待能够得到邻对位 取代的产物。然而真正的反应产物是1,3,5-三乙基苯,即所有烷基取代都是间位取代。 热力学反应控制使得该反应产生了热力学上更稳定的间位产物。通过化学平衡,间位产物比起邻对位产物降低了空间位阻。因此反应最终的产物是一系列烷基化与去烷基化共同作用的结果。
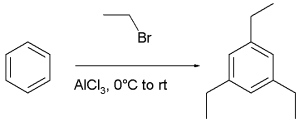
1,3,5-三乙基苯的合成
傅-克酰基化反应
傅-克酰基化反应是在强路易斯酸做催化剂条件下,让酰氯与苯环进行酰化的反应。此反应还可以使用羧酸酐作为酰化试剂,反应条件类似于烷基化反应的条件。酰化反应比起烷基化反应来说具有一定的优势:由于羰基的吸电子效应的影响(钝化基团),反应产物(酮)通常不会像烷基化产物一样继续多重酰化。而且该反应不存在碳正离子重排,这是由于酰基正离子可以共振到氧原子上从而稳定碳离子(不同于烷基化形成的烷基碳正离子,正电荷非常容易重排到取代基较多的碳原子上)。生成的酰基可以用克莱门森还原反应、沃尔夫-凯惜纳-黄鸣龙还原反应或者催化氢化等反应转化为烷基。
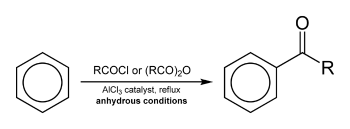
条件:氯化铝为催化剂,回流,无水
傅-克酰化的成功与否取决于酰氯试剂的稳定性。比如甲酰氯就由于不稳定而不能进行,因此合成苯甲醛就需要其他的方法,如Gattermann-Koch反应:在氯化铝和氯化亚铜的催化下,通过苯、一氧化碳与氯化氢在高压当中合成。
反应机理
第一步是在路易斯酸的条件下,氯的解离形成酰基碳正离子:
第二步是接下来的芳环亲电试剂进攻酰基正离子:
最后一步,电荷转移至氯原子形成HCl,而AlCl3催化剂重新形成:
如果需要的话产生的芳香酮可以接着被还原形成相应的芳环烷基侧链,见:沃尔夫-凯惜纳-黄鸣龙还原反应或者Clemmensen还原,两者的区别在于溶剂的酸碱性。
傅-克羟基烷基化
芳环和一定的醛酮形成相应的羟基取代的烷基化产物:
展望与变化
该反应与以下经典的人名反应相关:
酰化产物可以通过Clemmensen还原转化成烷基化产物。
Gattermann-Koch反应可以通过苯来合成苯醛。
Gattermann反应可以通过氢氰酸对芳环进行甲酰化。
Houben-Hoesch反应可以通过氰类化合物来合成芳醛。
Fries重排反应可以通过芳基酯重排得到芳基酮。
Scholl反应可以让两个芳基直接偶联(有些时候被称作 Friedel–Crafts芳香化)。
Zincke–Suhl反应可以让甲基苯酚和四氯化碳反应得到环己烯二酮。
布兰克氯甲基化反应:通过盐酸,氯化锌的催化通过甲醛将氯甲基引入芳基。
Bogert-Cook合成 (1933) 通过脱水反应和异构化,将 1-β-苯乙环己醇 合成菲。
Darzens-Nenitzescu酮合成法(1910, 1936) 将环己烯和乙酰氯反应得到甲基环己基酮。
Nenitzescu还原酰化(1936)
绿色化学当中,氯化铝被石墨代替用于和2-溴丁烷进行对二甲苯的烷基化。因为其碳正离子的稳定性更弱,此类反应不适用于一级卤代烃。
染料
Friedel–Crafts反应应用于很多染料的合成,比如:三苯基甲烷和氧杂蒽染料。 图例通过两当量的百里酚和邻苯二甲酸酐合成百里酚酞(一种pH指示剂)。
图例通过邻苯二甲酸酐和间苯二酚在氯化锌的催化下得到氟代荧光素。而在反应中用N,N-二乙基氨基酚取代间苯二酚做则得到罗丹明B:
Haworth 反应
Haworth反应是合成1-四氢萘酮的一个传统方法。 在这个例子当中苯和琥珀酸酐反应,中间产物被还原,然后继续和羧酸进行FC酰化。 (参见:[1])
另外一个相关反应,从萘作为原料合成菲就是利用琥珀酸酐进行了一系列的反应。
利用傅-克反应进行芳香烃类的检测
利用氯仿和氯化铝催化剂和芳香化合物反应得到三芳香环取代甲烷,由于通常具有亮丽的颜色这种反应能够用来在实验室内检验芳香化合物。
拓展
如同克莱森重排的发展一样,傅-克酰基化反应先是在芳香族化合物的反应中发现和应用,而后来发现该反应同样适用于非芳香族化合物(主要是烯烃)。比如环己烯与乙酰氯在三氯化铝的作用下生成共轭环己烯基酮,而这个方法已经发展为一种重要的合成共轭不饱和酮的方法(Nenitzescu反应)。
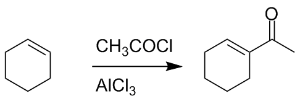
比如在天然产物kelsoene的一种合成方法中就利用了分子内非芳香Friedel–Crafts反应:
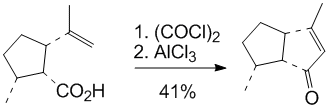
非芳香族化合物中发生的傅克烷基化反应也很常见。最常见的是分子内发生的傅克烷基化反应(但往往冠以其他称呼,比如说阳离子成环反应之类,本质上就是傅-克反应的一种变体。)
参见
亲电取代反应
加特曼-科赫反应
参考资料
在有机合成杂志中的FC(Friedel–Crafts)反应
烷基化:
酰基化:
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

相关资料
展开
- 有价值
- 一般般
- 没价值








推荐阅读
关于我们

APP下载

















