更多文章
更多精彩文章

影响溶解度的因素
本性
根据溶液的化学结构和溶解度特性,溶质和溶剂通常分为两大类:极性和非极性。极性与物质溶解性的关系可以被概括为“相似相溶”:溶质和溶剂有相似性质时,会有较大的溶解度。极性分子溶于极性分子,非极性分子溶于非极性分子。精确的来说,极性溶剂能够溶解离子化合物以及能离解的共价化合物,而非极性溶剂则只能够溶解非极性的共价化合物。常见的范例包括:
食盐,是一种离子化合物,它能在水中溶解,却不能在乙醇中溶解。
油脂,是一种非极性的共价化合物,他不能在水中溶解,却反而在乙醇中溶解 。
若将不能互溶的水及非极性溶剂放在一起,它们不会形成均一的混合物,反而会分离为两层,或形成看起来像牛奶一样的乳浊液。
温度
根据勒沙特列原理,溶解为吸热反应时,溶解度随温度升高而增加,常见的例子包括:
大部分的盐类
溶解为放热反应时,溶解度随温度升高而降低,例如:
气体
强电解质
部分硫酸盐类(如硫酸钙)
部分碳酸盐类(如碳酸钙)
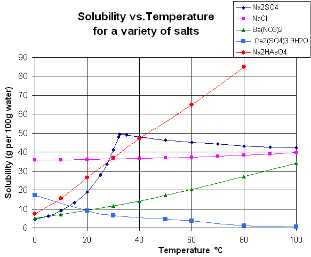
右图是一张常见固体盐类的溶解度与温度的关系图,可以见到溶解为放热反应的硫酸铯斜率为负,溶解为吸热反应的硝酸钡斜率为负。实验上调配饱和溶液时,常常使用此等溶解度-温度图来判断距离饱和点的距离;在关系曲线上方的数据点为过饱和溶液,在关系曲线上的点为饱和溶液,在关系曲线下方的点为未饱和溶液。
关系曲线中途折断的,表示在相应于转折点的温度时,溶液组成发生了变化。例如硫酸钠的溶解度曲线在305.4K有一个转折点,表示在305.4K由 N a 2 S O 4 ⋅ ⋅ --> 10 H 2 O {\displaystyle Na_{2}SO_{4}\cdot 10H_{2}O} 脱水转化成 N a 2 S O 4 {\displaystyle Na_{2}SO_{4}} 。
压强
固体和液体
对固体和液体而言,理想溶液下,压力对溶解度的关系可以用数学式表达为:
( ∂ ∂ --> ln --> N i ∂ ∂ --> P ) T = − − --> V i , a q − − --> V i , c r R T {\displaystyle \left({\frac {\partial \ln N_{i}}{\partial P}}\right)_{T}=-{\frac {V_{i,aq}-V_{i,cr}}{RT}}}
其中哑符号 i {\displaystyle i} 表示混和溶剂中的第 i {\displaystyle i} 种溶质, N i {\displaystyle N_{i}} 为其莫耳数, P {\displaystyle P} 表示压力, V i , a q {\displaystyle V_{i,aq}} 是其已溶部分的偏莫耳体积, V i , c r {\displaystyle V_{i,cr}} 是其未溶部分的偏莫耳体积, R {\displaystyle R} 是理想气体常数, T {\displaystyle T} 表示一特定温度 。通常,压力对固体溶质、液体溶质的影响甚小,可以忽略 。但是在某些情况下此一性质极为重要,例如在矿业中,硫酸钙(溶解度随着压力降低)或会引起油田和油井沉淀结垢,久而久之可能导致生产率降低。
气体
对气体而言,依据亨利定律,压力对溶解度的关系可以用数学式表达为:
k H {\displaystyle k_{H}} 为一不受温度引响之系数, p {\displaystyle p} 是该气体分压, c {\displaystyle c} 为该气体的体积莫耳浓度 。亨利定律常见的应用包括:
当汽水瓶打开时,会有气体逸出,乃是因为瓶盖打开时,压力降低造成二氧化碳溶解度降低而释出。
水作为溶剂时的溶解度
离子化合物
碱金属及含铵根(NH 4 )的化合物
硝酸盐
醋酸盐(乙酸盐) (含银离子的微溶)
氯化物、溴化物及碘化物(含银离子(Ag )、铅离子(Pb )、亚铜离子(Cu )或亚汞离子(Hg 2 )的则不溶)
硫酸盐(含银离子(Ag )、铅离子(Pb )、钡离子(Ba )、锶离子(Sr )或钙离子(Ca )的则不溶)
碳酸盐(含碱金属或铵根的仍可溶)
亚硫酸盐(含碱金属或铵根的仍可溶)
磷酸盐(含碱金属或铵根的仍可溶)
氢氧化物及氧化物(含碱金属、钡离子(Ba )、锶离子(Sr )、铊离子(Tl )或铵根的仍可溶,钙离子(Ca )微溶于水)
硫化物(含碱金属、碱土金属或铵根的仍可溶)
稀有气体
稀有气体随着原子序数的增大,在水中的溶解度也逐渐增大。如氦极难溶于水但氙能很好地溶于水中。
相关条目
溶度积
分配系数 (LogP)
浓度
互溶
参考资料
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。












{{item.time}} {{item.replyListShow ? '收起' : '展开'}}评论 {{curReplyId == item.id ? '取消回复' : '回复'}}