



自由基取代反应
自由基取代反应在自由基卤化反应(英语:freeradicalhalogenation)中,自由基取代的发生和卤素试剂及烷烃取代基有关。另一个重要的自由基取代基是芳基,其中一个例子是Fenton试剂(英语:Fenton"sreagent)产生苯环羟化的反应。在有机化学中许多氧化和还原反应有自由基的中间产物,例如羧酸与铬酸反应产生醛类的氧化。偶联反应也可以被视为自由基取代。某些芳香的取代反应是由自由基亲核芳香取代反应(英语:radical-nucleophilicaromaticsubstitution)来达成。自动氧化是造成涂料及食品劣化的原因,实验室中会因为自动氧化产生过氧化乙醚(英语:diethyletherperoxide),也是实验室危害的原因之一。更多自由基取代反应::Barton-McCombie去氧反应,是用氢离子去取代羟基。沃尔–齐格勒溴化反应反应涉及烯烃的烯丙基溴化反应。汉...
自由基取代反应
在自由基卤化反应(英语:free radical halogenation)中,自由基取代的发生和卤素试剂及烷烃取代基有关。另一个重要的自由基取代基是芳基,其中一个例子是Fenton试剂(英语:Fenton"s reagent)产生苯环羟化的反应。在有机化学中许多氧化和还原反应有自由基的中间产物,例如羧酸与铬酸反应产生醛类的氧化。偶联反应也可以被视为自由基取代。某些芳香的取代反应是由自由基亲核芳香取代反应(英语:radical-nucleophilic aromatic substitution)来达成。自动氧化是造成涂料及食品劣化的原因,实验室中会因为自动氧化产生过氧化乙醚(英语:diethyl ether peroxide),也是实验室危害的原因之一。
更多自由基取代反应::
Barton-McCombie去氧反应,是用氢离子去取代羟基。
沃尔–齐格勒溴化反应反应涉及烯烃的烯丙基溴化反应。
汉斯狄克反应从羧酸的银盐转换成烷基卤化物。
Dowd–Beckwith扩环反应反应涉及β-酮酯的扩环反应。
Barton反应涉及亚硝酸盐变成亚硝基醇。
Minisci反应(英语:Minisci reaction)是羧基以银盐反应产生烷基自由基,并与芳香族化合物反应产生的取代反应。
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。
——— 没有了 ———
编辑:阿族小谱

文章价值打分
- 有价值
- 一般般
- 没价值
当前文章打 0 分,共有 0 人打分
文章观点支持

0

0
文章很值,打赏犒劳一下作者~

发表评论
写好了,提交
{{item.label}}
{{commentTotal}}条评论
{{item.userName}}
发布时间:{{item.time}}
{{item.content}}
回复
举报


打赏作者
“感谢您的打赏,我会更努力的创作”
— 请选择您要打赏的金额 —
{{item.label}}


{{item.label}}

打赏成功!
“感谢您的打赏,我会更努力的创作”
返回
打赏
私信
推荐阅读
· 取代反应
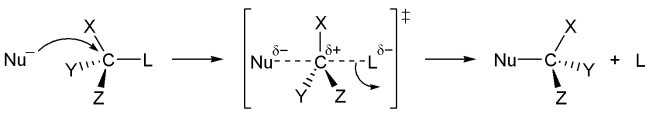
亲核取代反应亲核取代反应是取代反应的一种基本型式,指亲核基与带正电或部分正电的原子或原子团反应并取代它。被取代的原子或原子团称为离去基;带正电的原子或原子团为亲电子基;带有离去基和亲电子基的整个原始分子则称为受质。亲核取代反应的通式如下:亲核基利用电子对(:)攻击受质(R-LG)形成一个新的键结,同时受质上的离去基(LG:)键结被打断并离去,反应结束,得到此反应的主要产物(R-Nuc)。亲核基可以是电中性或带负电荷,受质上的亲电子基则通常为电中性或带有正电荷。亲核取代反应可以根据反应的速控步涉及到几个分子的化学变化分为单分子亲核取代反应(SN1)与双分子亲核取代反应(SN2)。以下将简略说明。SN2与SN1反应双分子亲核取代反应(SN2反应),亲核取代反应的一种。反应过程为亲核基直接攻击中心碳原子形成键结,几乎同时离去基与中心碳原子键结断裂并离去,其过度态是一个碳五键的分子,如下图。此反应...
· 亲电取代反应
芳香烃的亲电取代这种类型中最重要的反应包括芳香环系的硝化反应、卤代反应、磺化反应以及傅-克反应(Friedel-Crafts)。脂肪族的亲电取代在脂肪族化合物的亲电反应中,亲电试剂取代反应物的一个官能团。该反应与更为常见的脂肪族亲核取代反应类似,只不过进攻基团是亲电试剂而非亲核试剂。脂肪亲电取代反应也可分为两种机制,即SE1和SE2,这与脂肪亲核取代反应可分为SN1和SN2是类似的。典型的脂肪族亲电取代反应包括:酮上α-氢的卤代反应卡宾对碳-氢键的插入反应参见氟代脱氧葡萄糖(核医学)参考文献March,Jerry.AdvancedOrganicChemistry5thed.Wiley.1985.引文格式1维护:冗余文本(link)
· 亲核取代反应
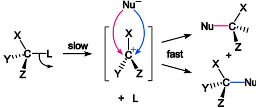
单分子亲核取代反应SN1亲核取代反应机理如下:第一步是原化合物的解离生成碳正离子和离去基团,然后亲核试剂与碳正离子结合。由于速控步为第一步,只涉及一种分子,故称SN1反应。常发生于:碳上取代基较多(如:(CH3)3CX),使得相应碳正离子的能量更低,更加稳定。同时位阻效应也限制SN2机理中亲核试剂的侵蚀。对碳阳离子生成有利条件:有许多释电子基团帮助稳定碳阳离子的正电荷(3级碳>2级碳>1级碳),一级碳几乎不能够单独存在,而会立刻和周遭发生化学反应而形成内能更低的分子。SN1亲核取代反应特点:反应速率决定步骤在于离解一步(第一步),所以根据动力学理论推断该反应为一级速率反应,r=k[{\displaystyle\r=k[}反应物]{\displaystyle\]}。从立体化学观点来看,该反应的反应物若为光学异构物之一,则产物反转概率略大于50%。在碳阳离子形成时,整个分子略呈现平面三角形,亲...
· 芳香族亲核取代反应
参见取代反应亲核取代反应
· 双分子亲核取代反应
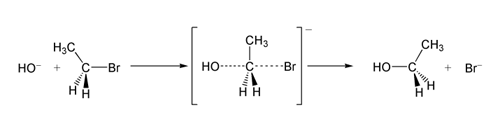
反应机理SN2反应最常发生在脂肪族sp杂化的碳原子上,碳原子与一个电负性强、稳定的离去基团(X)相连,一般为卤素阴离子。亲核试剂(Nu)从离去基团的正后方进攻碳原子,Nu-C-X角度为180°,以使其孤对电子与C-X键的σ反键轨道可以达到最大重叠。然后形成一个五配位的反应过渡态,碳约为sp杂化,用两个垂直于平面的p轨道分别与离去基团和亲核试剂成键。C-X的断裂与新的C-Nu键的形成是同时的,X很快离去,形成含C-Nu键的新化合物。由于亲核试剂是从离去基团的背面进攻,故如果受进攻的原子具有手性,则反应后手性原子的立体化学发生构型翻转,也称“瓦尔登翻转”。这也是SN2反应在立体化学上的重要特征。反应过程类似于大风将雨伞由里向外翻转。溴乙烷与氢氧根离子发生SN2生成乙醇和溴离子。上例中,OH−(亲核试剂)进攻C2H5Br(底物)发生SN2反应,经过不稳定的过渡态,最终Br−离去,得到乙醇。SN2...
关于我们

关注族谱网 微信公众号,每日及时查看相关推荐,订阅互动等。
APP下载

下载族谱APP 微信公众号,每日及时查看

扫一扫添加客服微信
















