



脂肪酸合成
直链脂肪酸
直链脂肪酸具有两种型态:饱和直链脂肪酸以及不饱和直链脂肪酸
饱和直链脂肪酸
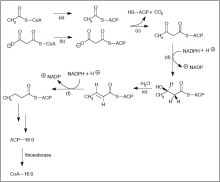
大肠杆菌借由脂肪酸合成酶II合成饱和直链脂肪酸
细胞通过不断重复进行下表六个类似β氧化的反应可以获得具有十六个碳的棕榈酸。 左图描绘了大肠杆菌中的脂肪酸合成酶II(缩写为FASII,一个由多种酵素结合成的复合体)如何产生饱和直链脂肪酸,这种酵素复合体能够在原核生物、真菌、植物、寄生虫以及线粒体内找到。
大多数真菌、酵母菌以及动物体内的饱和直链脂肪酸是利用脂肪酸合成酶I进行合成。脂肪酸合成酶I是一种巨大而多功能的二聚体蛋白质酵素,具有催化脂肪酸合成过程所有步骤的能力。脂肪酸合成酶I不仅能够合成直链脂肪酸也能够合成具有支链的脂肪酸。
在合成出(16:0)棕榈酸(16个碳,0个双键)之后,可以再经由一连串的修饰延长碳链或是增加不饱和度(或两者皆是)。延长的产物,如18:0硬脂酸。进行延长作用的地点是在内质网上,而延长的反应通常由一个蛋白质催化完成,但其复合体的物理结构可能可以协助其反应进行。
调控机制
乙酰辅酶A经过乙酰辅酶A羧化酶的作用可以转化为丙二酰辅酶A,当反应进行到这一步时,便注定要完成脂肪酸合成这一条代谢路径了(这称为承诺反应,committed step)。而乙酰辅酶A羧化酶也同时受到异位调控以及磷酸化调控(磷酸化调控常见于哺乳动物)。其中乙酰辅酶A羧化酶的异位调控会受到棕榈酰辅酶A(脂肪酸合成的最终产物)抑制,而被柠檬酸(在克氏循环中与乙酰辅酶A一起被合成出来)活化。生物可以借由这点调控饱和直链脂肪酸的合成。
人类的De Novo Synthesis
De Novo 在西班牙文中是“新”的意思,因为人类是从无到有合成脂肪酸,所以这样命名。人类的脂肪酸主要是由肝脏以及哺乳期妇女的乳腺制造,也有一部分的脂肪酸是由脂肪组织合成。主要原料乙酰辅酶A大多是在线粒体中由丙酮酸脱氢酶分解丙酮酸而来,接着乙酰辅酶A与草酰乙酸被柠檬酸合成酶合成柠檬酸,再将柠檬酸移往细胞质中由ATP柠檬酸裂解酶再次分解成乙酰辅酶A和草酰乙酸。最后乙酰辅酶A将作为脂肪酸合成的原料,而草酰乙酸则被还原为苹果酸返回柠檬酸循环中。
去饱和
去饱和指的是让饱和脂肪酸转为不饱和脂肪酸的过程,这过程需要氧分子、NADH以及细胞色素 b5的参与。脂肪酸的去饱和反应,发生在细胞的内质网上,会造成脂肪酸的氧化并生成一个NADH。在生物中的去饱和反应有无氧以及有氧两种。而脂肪酸上最常发生去饱和的地方是在C9-C10的地方。
不饱和脂肪酸不论在真核生物或是原核生物中都扮演极重要的角色:细胞膜上主要的成分就是不饱和脂肪酸,因为细胞膜中的不饱和脂肪酸可以保持细胞膜的流动性 ,或著成为细胞膜上传递讯息、供其他细胞辨识的分子。
无氧去饱和
许多微生物用无氧的去饱和反应合成不饱和脂肪酸,在16:0棕榈酸被合成后先去饱和形成双键接着再进行延长的动作。
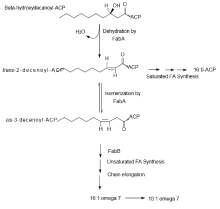
经由无氧去饱和反应合成不饱和脂肪酸
FabA是一种β-hydroxydecanoyl-ACP dehydrase(脱水酶),它会针对10:0的脂肪酸前驱物进行反应
FabA催化的反应会生成一个水分子,并将10:0脂肪酸前驱物C7-C8(由甲基尾端开始算)之间转为双键
FabB可以将trans-2-decenoyl这项中间产物透过水分子的参与重新转为饱和
FabB是一种β-ketoacyl-ACP synthase(合成酶),它可以延长并引导trans-2-decenoyl中间产物与cis-decenoyl中间产物合成不饱和脂肪酸
这两种酵素的产物是(16:1ω7)不饱和棕榈酸-ACP以及(18:1ω7)顺-不饱和硬脂酸-ACP
这整个反应由FabR以及FadR的转录调控控制。其中FadR蛋白扮演了两个重要的角色: fabA 与 fabB 序列转录的活化因子以及β-氧化的抑制因子。FabR蛋白则是 fabA 与 fabB 序列转录的抑制因子。
有氧去饱和
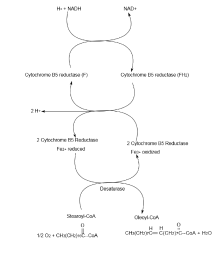
经由有氧去饱和反应合成不饱和脂肪酸
有氧去饱和是将饱和脂肪酸转为不饱和脂肪酸最常见的方式,在所有的真核生物以及部分的原核生物中都可以观察到。借由这条反应途径可以将饱和脂肪酸转化为具有相同碳数的不饱和脂肪酸,也可以在脂肪酸的支链上加上双键 。在枯草杆菌( Bacillus subtilis )中具有可以在Δ 位置加上顺式双键(cis-double bond)的酵素Δ -Des,而在酿酒酵母菌( Saccharomyces cerevisiae )中则有在Δ 位置加上顺式双键的酵素Ole1p。酿酒酵母菌( S. cerevisiae )利用双调控系统(Two-component regulatory system)控制去饱和反应,借由DesK和DesR这两种蛋白之间的互动来调控。其中DesK是一种位在细胞膜上的激酶而DesR则是 des 基因的转录调控因子。这套调控系统受到温度影响,当温度降低时会增加脂肪酸的产量;当温度升高时脂肪酸产量则会下降。
铜绿假单胞菌
在正常情况下,无氧和有氧的不饱和脂肪酸合成不会在同一个系统内发生,但 铜绿假单胞菌 ( Pseudomonas aeruginosa )和 弧菌 ( Vibrio )ABE-1为例外。 铜绿假单胞菌会同时进行一个无氧的去饱和反应以及两个有氧的去饱和反应。其中一个反应是利用DesA蛋白催化生成用来构造细胞膜的不饱和脂肪酸。另一个反应则是利用DesB以及DesC两种蛋白来进行脂肪酸辅酶A的不饱和化,这个反应受到DesT的抑制。而DesT同时也是 fabAB 序列转录的抑制因子。
非直链脂肪酸
具有支链的脂肪酸通常都是饱和脂肪酸并依型态分为两个族群:iso-series以及anteiso-series。
α-酮酸合成路径
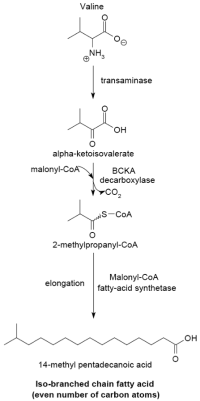
缬氨酸引子 亮氨酸引子 异亮氨酸引子 利用不同引子合成脂肪酸
本系统以α-酮酸作为引子合成支链脂肪酸,见于大部分生物中(包含部分细菌)。 α-酮酸系统的反应由缬氨酸、亮氨酸和异亮氨酸的转氨化以及去羧化开始,经过这两种反应合成3-甲基丁酰辅酶A和2-甲基丁酰辅酶A。 由缬氨酸反应得到的2-甲基丁酰辅酶A可以作为引子进行延长,合成具有偶数碳数的iso-series脂肪酸。由亮氨酸反应得到的3-甲基丁酰辅酶A则可以作为引子进行延长,合成具有奇数碳数的iso-series脂肪酸。最后,由异亮氨酸反应得到的2-甲基丁酰辅酶A则可以作为引子进行延长,合成具有奇数碳数的anteiso-series脂肪酸。
若是借由酵素 BCKA (branched-chain α-keto acid decarboxylase)对这些引子前驱物进行去羧化,则可以经由与大肠杆菌合成饱和直链脂肪酸类似的路径去合成支链脂肪酸。 这条反应路径的产物是一群碳数为12到17的脂肪酸。其脂肪酸种类惠依照细菌种类而定(不同的细菌会依此路径合成不同脂肪酸),故也可以依此分类细菌。
BCKA脱羧酶与相对应的α-酮酸
BCKA是一个由两个次单元(A 2 B 2 )所组成的四聚体酵素,为合成支链脂肪酸所必需的酵素之一。BCKA的功能主要是将α-酮酸去羧化,这项功能在支链脂肪酸的合成上远比在直链脂肪酸的合成重要。而在芽孢杆菌属生物中的重要性又特别高(芽孢杆菌属由α-ketoisocaproate以及α-ketoisovalerate合成脂肪酸)。 BCKA对支链α-酮酸的高亲和力造就了其对于支链脂肪酸的合成不可或缺的地位。
影响碳链长度的因子
以α-酮酸作为引子合成支链脂肪酸时,产物通常都是碳数介于12到17之间的脂肪酸,其确切的碳数与物种有关。但是丙二酰辅酶A的浓度、温度以及温度稳定因子(Heat stable factor,HSF)的参与都会影响其结果。虽然上述因素皆可以影响产物的碳数,但温度稳定因子的影响仅限于仰赖BCKA催化的反应途径。丙二酰辅酶A的浓度越高,产物中C17的脂肪酸比例就越高(直到C17脂肪酸的浓度到达大约20μM为止)。而杆菌生产C17脂肪酸的比率则依温度下降些微降低。
短链分子合成路径
这套系统以异戊酸、异丁酸和2-甲基丁酸这种短链分子作为引子合成支链脂肪酸,出现于无法使用α-酮酸作为引子的细菌-瘤胃菌(ruminal bacteria)中。其所需的材料(即异戊酸、异丁酸和2-甲基丁酸)在环境中皆可轻易取得,其总反应式为:
此套系统与α-酮酸合成路径最大的差别是其主要酵素的功能是将乙酰辅酶A转换为乙酰-ACP。
ω-脂环族脂肪酸
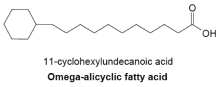
典型的ω-脂环族脂肪酸在ω端(甲基尾端)具有3碳或4碳环状结构,在细菌中十分常见。合成ω-脂环族脂肪酸的酵素通常也能合成细胞膜上的支链脂肪酸,在一些细菌中甚至以ω-脂环族脂肪酸作为主要成分,因为环状小分子引子在细胞中的供给量远比直链状引子多。 目前我们对这条反应的机制仍不清楚,但可以确定的是其途径是由糖类转化为莽草酸最后生成环已烷酸类辅酶A作为引子合成脂肪酸。
结核硬脂酸
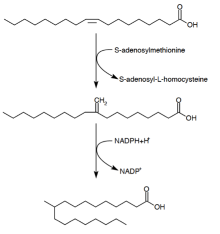
结核硬脂酸的合成机制
结核硬脂酸( D -10-Methylstearic acid)是一种由一个分枝杆菌属( Mycobacterium spp. )以及两个链霉菌属( Streptomyces )的物种所制造的脂肪酸。以油酸(oleic acid) 为前驱物与S-腺苷甲硫氨酸(S-adenosyl-methionine)进行酯化(esterify)形成一种磷脂,以NADPH辅助因子进行反应,最后产生10-甲基硬脂酸。
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

- 有价值
- 一般般
- 没价值








推荐阅读
关于我们

APP下载



















