



凝胶电泳
物理原理
凝胶电泳是由“凝胶”和“电泳”两个术语复合而成。
凝胶是固态的、多孔隙的交联聚合物,是整个实验进行的基质。大多数情况下,凝胶是由交联的多聚物组成的。多聚物的组成和孔隙都会根据目标分子的性质来设计。
在分离蛋白质和小核酸(DNA、RNA、寡核苷酸)时,凝胶通常由不同浓度的丙烯酰胺和交联剂聚合而成;在分离大一点的核酸时(长度超过几百个碱基),纯化的琼脂更适合作为基质。
电泳是利用电场力移动凝胶基质中的分子的一种方法。将含有待测分子的样本放入凝胶上的井(wells)中,并且施加电场,待测分子就会以不同的速率通过基质。
凝胶制备
“凝胶电泳”的第一个部分“凝胶”,是指用来分离分子的基质(matrix)。大致上凝胶是个可以被科学家控制多孔性(porosity)的交联聚合物。在分离蛋白质或小的核酸(DNA、RNA,或寡核苷酸)的时候,凝胶通常是用不同浓度的丙烯酰胺和一个交联剂聚合而成,形成不同大小网眼的聚丙烯酰胺网状系统。
分离较大的核酸(超过几百个碱基对时)较常用的基质是纯化的洋菜胶,洋菜胶是海藻(seaweed)的萃取物。
在以上两者里的凝胶都是形成固体但是具孔隙的基质,外观和触感都像透明的果冻。不像聚丙烯酰胺产物,丙烯酰胺本身是种神经毒素,需要按良好药品实验研究规范(Good Laboratory Practices,GLP)操作以避免毒性。
电泳方法
琼脂糖凝胶电泳,将样品加入凝胶的样品孔中
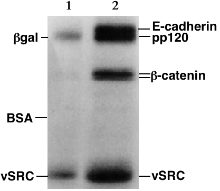
SDS-PAGE自射线摄影 - 蛋白质是目前在不同浓度的两个样品。
第二个部分,“电泳”,是指在凝胶(琼脂糖凝胶或十二烷基硫酸钠聚丙烯酰胺凝胶电泳)上用来推动或拉住分子的电动势(electromotive force, EMF);将待测分子放进凝胶上的井(wells)并导入适当的电流,分子就会以不同的速率在有孔隙的胶体中移动;如果分子带负电多就会往氧化极(anode),带正电多就往还原极(cathode)移动(注意到胶凝电泳操作原理相似于电解池,氧化极带正电而还原极带负电)。在核酸(DNA或RNA)的例子里,待测分子从负电极到正电极的移动方向是因为核酸骨架上的磷酸盐携带负电。双股DNA片段自然的形成长杆状(long rods),所以核酸片段在凝胶内的移动和他们的旋转半径(radius of gyration)有关。简单的说,就是和分子大小相关。单股DNA或RNA倾向于折叠成复杂形状的分子,根据他们的三级结构以复杂的方式在凝胶内移动。因此,像是氢氧化钠或甲酰胺这类可以破坏氢键的化学物,就用来把DNA或RNA从三级结构变性,再度形成长杆状。
另一方面,蛋白质有不同的电荷和复杂的形状,所以当放电动势(EMF)在样品上,蛋白质可能会以不同的速度进入凝胶或完全不移动。所以蛋白质在有洗涤剂,如:十二烷基硫酸钠,SDS/十二烷基磷酸钠,SDP))出现时会变性。洗涤剂会以负电荷覆盖蛋白质。通常SDS键结的量跟蛋白质的大小有关系,所以键结后变质的蛋白质带有负电荷,而且所有蛋白质有相似的“荷质比”(电荷和质量的比值)。因为变质的蛋白质移动方式像是长杆状,而不是复杂的三级结构,和SDS结合的蛋白质在凝胶内移动的速率只和它的大小有关,跟它的带电量或形状无关。
在跑完电泳,最小的分子几乎到达氧化极之后,可以对凝胶里的分子染色,这样才能看到分子。可以用溴化乙锭,银或考马斯亮蓝染色。也可以用其他方法看到凝胶里分离后的混合物组成。如果分析物的分子在紫外线下会发光,就可以在紫外线下拍出凝胶的照片。如果要分离的分子有放射性原子,凝胶可以用同位素示踪剂记录,记录方法同上面所述。
如果一开始有很多个混合物一个接一个注入相邻的“井”〈wells〉,跑出来的结果会是一条一条平行的轨迹〈lane〉。根据不同分子的数量,每一条轨迹都有一条或以上,明显的亮带(band),表示原本混合物分离出来的组成,每个亮带代表一个组成,组成物分离不完全就会跑出重叠的亮带,或者难以辨别的污点(smear)就表示许多组成物没有分解。
种类
凝胶电泳被用于分子生物学、遗传学和生物化学:
大的DNA或者RNA分子通常利用琼脂糖凝胶电泳(agarose gel electrophoresis)分离,也可以使用聚丙烯酰胺凝胶电泳(PAGE)。
蛋白质的凝胶电泳通常在加入十二烷基硫酸钠聚丙烯酰胺凝胶电泳中进行,或者非变性凝胶电泳,或二维电泳。
毛细管电泳
酶谱法(zymography)
变性梯度胶凝电泳(Denaturing Gradient Gel Electrophoresis,DGGE)
参见
蛋白质电泳
等电聚焦
南方墨点法
北方墨点法
西方墨点法
^Sambrook J, Russel DW (2001). Molecular Cloning: A Laboratory Manual 3rd Ed. Cold Spring Harbor Laboratory Press. Cold Spring Harbor, NY.
^Berg JM, Tymoczko JL Stryer L.Biochemistry5th. WH Freeman. 2002. ISBN 0-7167-4955-6.
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

- 有价值
- 一般般
- 没价值








24小时热门
关于我们

APP下载



















