



分子轨道
参见分子轨道理论原子轨道分子轨道能级顺序图,也称MO图计算化学-量子化学电子构型-HOMO/LUMO
参见
分子轨道理论
原子轨道
分子轨道能级顺序图,也称MO图
计算化学-量子化学
电子构型-HOMO/LUMO
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。
——— 没有了 ———
编辑:阿族小谱

文章价值打分
- 有价值
- 一般般
- 没价值
当前文章打 0 分,共有 0 人打分
文章观点支持

0

0
文章很值,打赏犒劳一下作者~

发表评论
写好了,提交
{{item.label}}
{{commentTotal}}条评论
{{item.userName}}
发布时间:{{item.time}}
{{item.content}}
回复
举报


打赏作者
“感谢您的打赏,我会更努力的创作”
— 请选择您要打赏的金额 —
{{item.label}}


{{item.label}}

打赏成功!
“感谢您的打赏,我会更努力的创作”
返回
打赏
私信
推荐阅读
· 分子轨道对称守恒原理
电环化反应分子轨道对称守恒原理最初用于解释电环化反应在光照和加热下生成不同产物的事实。1965年,霍夫曼和伍德沃德在美国化学会志上发表的题为“分子轨道对称守恒原理”的文章,其中将该规则归为三点:基态时,链形4n体系反应物的HOMO有不同的对称性,加热时都必须采取顺旋关环的方式;基态时,链形4n+2体系反应物的HOMO有相同的对称性,加热时都必须采取对旋关环的方式;光照时,反应物HOMO的一个电子被激发到LUMO上,因此反应选择性发生颠倒。分子轨道对称守恒原理还预测了一些带电荷的体系发生电环化反应时得到的产物:因此电环化反应的立体选择性可以通过下表来总结。需要注意的是,允许和禁阻仅代表特定条件下发生协同反应的活化能的相对大小,并不排除反应按照其他机理进行,也不代表反应能否进行的绝对可能性。轨道对称守恒的一般规则电环反应的轨道对称守恒规则被提出后,伍德沃德和霍夫曼又将其推广于其他周环反应。他们...
· 分子轨道理论
简介分子轨道理论认为,分子轨道由原子轨道线性组合得到,分布在整个分子之中。分子轨道仅仅是一个薛定谔轨道,包含数个(通常只有两个)原子核。由此可衍生出成键、反键和非键轨道的概念:如果组合得到的分子轨道能量比组合前原子轨道能量之和低,换句话说,原子核间电子云密度增大,那么所得分子轨道称作成键轨道;如果组合得到的分子轨道能量比组合前原子轨道能量之和高,即原子核间电子云密度减小,则称作反键轨道,以标注;如果组合得到的分子轨道能量与组合前原子轨道能量之和相差不大,轨道上的电子对分子键合没有贡献,那么该分子轨道则称作非键轨道,常以n标注。分子轨道法的基本要点,即LCAO-MO法的基本原则包括:对称性匹配原则:原子轨道必须具有相同的对称性才能组合成分子轨道,参见对称运算。最大重叠原则:原子轨道重叠程度越大,形成的化学键也越强。能量相近原则:能量相近的原子轨道才能组合成有效的分子轨道。除了遵照LCAO-M...
· 轨道
历史历史上,人们用本轮来描述行星的视运动,认为行星的运动是很多圆周运动合成的结果,这是一种几何方法,并没有涉及引力的概念。在开普勒证明行星的运动轨迹是椭圆之前,用这种方法来预测行星的轨迹勉强可行。最开始,人们使用以地球为中心的太阳系天球模型来解释行星的视运动。该模型假设存在一个完美的球体或圆环,所有的恒星和行星都在其表面运动。在更精确的测量了行星的运动后,人们引入了均轮和本轮这样的理论来描述行星运动。这种系统能更精确的预测行星的位置,但随着测量结果越来越精确,需要加入更多的本轮到模型中,因此,这种模型变得越来越繁琐。17世纪初,在约翰内斯·开普勒对大量精密观察的天体轨道数据进行分析后,得出著名的3个行星运动定律。第一,他发现太阳系中行星轨道不是以往人们想象的正圆形,而是椭圆的;太阳也不是位于轨道中心,而是在一个焦点上。第二,行星的轨道速度,也不是恒定不变的,事实上行星的轨道速度与当下行星至...
· π轨道
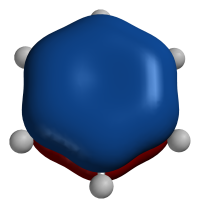
结构苯的π轨道呈环状,但中心仍有电子分布π轨道是一种由轨道并肩重叠后所形成的分子轨道,除了s轨道无法形成π轨道,之外,大部分的轨道都可以形成π轨道,较常是由两个pz轨道所形成,但实际上只要方向对了,无论是px或py都能形成π轨道。π轨道可以有很多形状,但都不与核轴成旋转对称,其形状取决于他所形成的π键,例如:有共振时,π轨道就会变得较大较狭长,若是环状的共振,则其π轨道呈环形。其能容纳的电子数量也由其所形成的π键来决定,如乙烯内所形成的π轨道可容纳下2个电子,而苯的π轨道呈环状,可容下6个电子,这是因为共振使电子均匀分布而导致。此外,在形成化学建的过程中,未杂化的轨愈有可能形成π轨道,如乙烯,碳上形成了sp杂化轨道,而未杂化的p轨道则形成π轨道。轨道能级丁二烯中,不同能级的π轨道及其形状。根据休克尔方法,可得出不同能量的π轨道,不同能级的π轨道形状不尽相同,电子会先从能量低的π轨道开始填入...
· d轨道
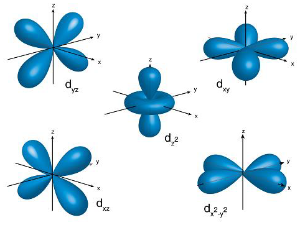
命名d轨道的“d”是“diffused”,其为“漫系光谱”之意。结构五种d轨道的形状,除了dz之外,其他四个形状相同,只是方向不同5d轨道模型,红色和蓝色中间空隙则为波节d轨道从主量子数n=3开始出现,最小的d轨道是3d轨道,也就是说1d、2d轨道不存在,当角量子数为2时,其轨道为d轨道,主量子数不可小于三,对应于五个磁量子数2、1、0、-1、-2,在3d轨道中,有五个能量相同的3d轨道,同样的,主量子数为4以上时也有五个4d轨道,因此,每个壳层都有五个d轨道,它们分别为dz、dx-y、dxy、dyz、dxz,但是没有dx、dy、dy-z、dx-z。在存在的五个d轨道(dz、dx-y、dxy、dyz、dxz)中,有四个形状相同,分别为:dx-y、dxy、dyz、dxz但方向不同,而dz是五个d轨道中形状与众不同的一个,尽管如此,dz轨道仍具有和dx-y、dxy、dyz及dxz相同之能量。4...
关于我们

关注族谱网 微信公众号,每日及时查看相关推荐,订阅互动等。
APP下载

下载族谱APP 微信公众号,每日及时查看

扫一扫添加客服微信















