



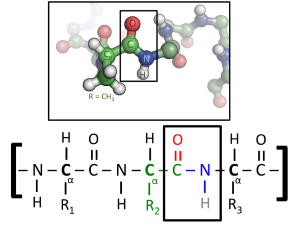
蛋白质折叠
折叠与氨基酸序列之间的关系
蛋白质的氨基酸序列决定于氨基酸的特性。蛋白质在生物合成的过程或是生物合成结束后进行折叠。蛋白质折叠受到许多环境因素的影响,例如:溶剂(水、脂类双层),盐的浓度、pH值、温度。可能会出现辅助因子(cofactor)或伴侣因子(chaperon)。
尽量减少疏水性蛋白暴露在水中,对蛋白质折叠来说是一个很好的驱动力,分子内的氢键则可以稳定蛋白质结构。氢键强度与环境有关,因此在自然情况下,被包覆于疏水性核心的氢键和存在于充满水环境下的氢键比起来,对于稳定性的贡献较多。
折叠与转译是同时进行的(co - translationly),因此蛋白质的C端被核糖体(ribosome)制作出来,N端同时进行折叠的过程。特化的蛋白:伴侣因子可以使蛋白质不与其他蛋白作用(防止非特定区域结合)。最好的例子就是Gro-EL系统,能够阻碍蛋白质非特定区域折叠的球蛋白(globular protein)。在真核生物中,伴侣因子称作热休克蛋白(heat shock protein)。即使球蛋白可以在没有任何辅助的情形下防止蛋白质非特定区域折叠,伴侣因子的作用在细胞内部还是需要的。伴侣因子也可以防止蛋白质在细胞高温或其他环境下产生错误的折叠或聚集。
目前两种蛋白质折叠有两种模型:
扩散碰撞模型(diffusion collision model),细胞核形成之时,蛋白质也同时形成二级结构,接着这些二级结构碰撞再一起并紧紧的包住。
成核缩合模型(nucleation-condensation model),二级和三级结构同时形成。近期的学说显示出某些蛋白具有以上的折叠现象。
大多数的科学家已能研究出许多相同的蛋白,将其聚合在一起。不论蛋白质是在恶劣的环境或是在天然状态下,氨基酸折叠过程大致上还是一样的,通常会先折叠成一般二级结构(secondary structure)或超二级结构(supersecondary structure),尤其是α-螺旋结构(alpha heliex)和β-折叠结构(beta sheet),之后再形成三级结构,若要形成四级结构则必须要和其他折叠完成的结构进行组装。一般的 α螺旋结构和β折叠结构很快就可以快速折叠因为有分子内的氢键稳定其结构,此现象第一个发现者为莱纳斯·鲍林(Linus Pauling)。蛋白质折叠另外还有共价键结参与──两个半胱胺酸(cysteine)间形成的双硫键(disulfide bridges)或是金属的聚集(metal clusters)。为了使能量达到稳定分子会形成中间产物:熔球(molten globule)型态。 事实上,每个蛋白质的氨基酸序列都含有在蛋白质在特定状态折叠的讯息,这并不表示的氨基酸折叠方式都是一样的。蛋白质折叠的构型也受到环境的影响,相同的蛋白在不同的环境下也会产生不同的折叠结构。折叠是一个不需消耗能量的自发性过程,折叠主要是由蛋白质的疏水作用主导,形成分子内氢键、范德瓦耳斯力。
自然状态的阻扰
蛋白质在某些情况下会形成有别于一般生物折叠的折叠结构,当环境的温度超出或低于细胞所能承受的温度时,会造成蛋白质的展开(unfold)或是变性,这同时也是蛋白在沸水中变得不透明的原因。高浓度溶液、极端的酸碱值、机械性影响以及其他会使蛋白质变性的溶剂都会造成类似的影响。但是,蛋白质的热平衡常数相当高(即高温才会产生变性的现象)。以超级嗜热菌(hyperthermophilic bacteria)为例,他可以在其高温度122∘C生存,其体内重要的蛋白质间的组合,在此温度或更高温时仍然能够维持的相当稳定。
一个已经完全变性的蛋白质缺乏三级结构与四级结构,形成所谓的随机螺旋(random coil),特定情况下蛋白质可以再次折叠(refold),然而,蛋白质的变性往往是不可逆的。细胞有时候会产生酵素──伴侣因子或热休克蛋白来预防蛋白质在高温中变性,伴侣因子或热休克蛋白可以抵抗蛋白质的不正常折叠与维持、协助正常折叠。有些蛋白质因为彼此间不会有交互作用或其功能为帮助未折叠或折叠错误的蛋白质二度折叠,因此伴侣因子不会阻止此类蛋白质折叠。此现象亦可防止蛋白质沉淀以及防止蛋白质产生不规则形状的结晶。
外在因子对蛋白质折叠的影响
许多外在因子像是温度、电场、磁场、分子的堆积,空间限制对于蛋白质的折叠会有很大的影响。 外在因子若对蛋白质局部极小修饰,亦可引发蛋白质产生不一样的折叠方式。 蛋白质折叠对于蛋白质来说是一个很好的调整过程,不同原子间的氢键所提供的力量是必要的,疏水性蛋白间的疏水性作用包覆住疏水性残基(residue)。
蛋白酶解(Proteolysis)
蛋白酶解经常用于探测出在广泛的溶液情况中(有许多影响因子)分离出没有被折叠的蛋白质。 快速并行蛋白酶解 ( 英语 : Fast parallel proteolysis ) 便是一个很好的例子。
蛋白的不正确折叠与神经退化症
有些不正常的蛋白聚集与许多疾病相关。
朊病毒相关的例如:克雅二氏症(Creutzfeldt-Jakob disease),又称作海绵状脑症(bovine spongiform encephalopathy)。又如牛脑海绵状病变。
类淀粉蛋白相关的疾病例如:阿兹海默症(Alzheimer"s disease)、家族性淀粉样蛋白心肌病(familial amyloid cardiomyopathy)以及多发性神经病变(polyneuropathy),还有细胞质(包浆)内聚集的疾病,例如:亨丁顿舞蹈症(Huntington"s disease)及帕金森氏症(Parkinson"s disease)。这些退化性的疾病起因皆与蛋白质的聚集并折叠错误使其不溶于水有关,胞外聚集或包裹在胞内形成 交叉β折叠淀粉样纤维(cross-beta sheet amyloid fibrils)。截至目前并不完全清楚这些不正常的蛋白质聚集现象是造成蛋白质失衡的主因还是只是蛋白质失衡所产生的反应。
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

- 有价值
- 一般般
- 没价值








24小时热门
推荐阅读

关于我们

APP下载



















