铀
特性
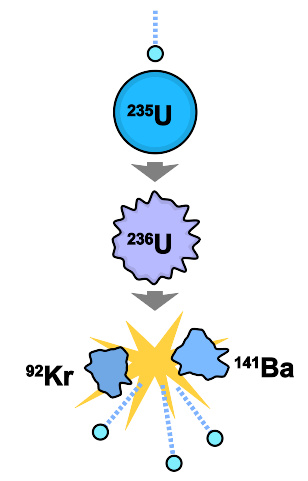
中子撞击促使铀-235产生核裂变。
在提炼之后,铀金属呈银白色,属硬度较高的元素之一。铀金属具延展性和可锻性,呈轻微顺磁性,电正性高,电导性低。 铀金属的密度非常高,它比铅金属高70%,但比金及钨稍低。
几乎所有非金属元素及其化合物都可与铀发生反应,反应活性随温度而提高。 氢氯酸和硝酸能溶解铀,而除氢氯酸外的非氧化性酸对铀的侵蚀则很慢。 铀金属粉末可与冷水反应。空气中,铀的表面会形成一层深色氧化铀。 矿石中的铀可通过化学方法提取出来,并转化为二氧化铀或其他工业可用的化学形态。
铀-235是首个被发现的可裂变同位素。其他自然产生的同位素为“可以裂变”物质,而非“可裂变”(两者之别请见可裂变物质)。在慢中子的撞击下,铀-235主要会分裂成两个较小的原子核,同时释放核结合能及更多的中子。当这些新产生的中子被足够多的原子核吸收,就会产生核连锁反应,瞬时发热或(在特殊情况下)发生爆炸。核反应堆会使用中子毒物,通过吸收多余的自由中子,来控制这类核连锁反应的速度。这种吸收中子的物质通常置于反应堆的控制棒中。
只要大约7公斤的铀-235就能够制成原子弹。 首次用于战争中的核弹小男孩原子弹使用的便是铀元素的核裂变反应,而首个核弹及摧毁长崎的胖子原子弹用的则是钚元素。
铀金属具有三种同素异形体:
α型:正交晶系,稳定温度上限为660 °C
β型:四方晶系,稳定温度区间为660 °C至760 °C
γ型:体心立方,从760 °C至熔点,此形态的延展性最高。
应用
军用

贫铀被多国军队用作制造高密度穿甲弹。
铀在军事方面的应用主要在于制造高密度穿甲弹。这种穿甲弹由贫铀组成,并掺有1至2%其他元素,形成合金。在高速击中目标时,由于其高密度、高硬度,并具有自燃性,它能够有效摧毁重装甲目标。坦克及其他车辆的装甲中也有使用贫铀。英、美及其他各国在波斯湾和巴尔干作战时使用了贫铀军备,由于可能在泥土中留下了铀元素,因此引起了环境安全及政治上的争论。
贫铀可用于制造储存或运载放射性物质的容器外壳。虽然铀本身具有放射性,但其高密度使它比铅元素更有效于阻挡强烈的辐射,例如镭所产生的辐射。 其他贫铀的应用包括飞机控制面的平衡物以及导弹进入大气层时的压载和保护性外壳。 由于密度极高,贫铀可用在惯性导航系统和陀螺仪式指南针当中。 贫铀比其他同样高密度的物质优胜,因为其加工、铸造简单,价格相对也较低。 接触贫铀时的主要危险在于氧化铀中毒,而非辐射(铀是一种弱α粒子射源)。
现在第二次世界大战晚期和整个冷战期间,多国利用铀-235作为可裂变爆炸物制造核武器。最初制成的有两种核弹:第一种使用铀-235,相对简单;另一种使用经转化铀-238形成的钚-239。之后生产的为更复杂,爆炸力也更大的裂变聚变核弹(氢弹),使用钚装置使氚氘混合物进行核聚变。这种核弹的外壳是不可裂变的铀(即贫铀),核聚变产生的快中子使该物质裂变,产生爆炸中超过一半的能量。
民用

核能发电是铀最常见的民间应用。
铀在民间主要在核电站中作核燃料用。假设完全裂变,一公斤的铀-235理论上可以产生80万亿焦耳的能量(8×10 焦耳),相等于3000吨煤。
商业核电站所用的铀一般含有3%的铀-235同位素。 CANDU和Magnox反应堆是能够使用非浓缩铀作为燃料的仅有的两种反应堆。美国海军所用的核反应堆通常使用高浓缩铀,铀-235的比例较高(实际百分比被列为机密)。快中子增殖反应堆可经过一下反应将铀-238转化为钚: U (n, γ) → U -(β) → Np -(β) → Pu.

在紫外线照射下发光的铀玻璃
在放射性被发现之前,铀主要被用在黄色玻璃及陶器彩釉当中,如铀玻璃等。
玛莉·居礼在铀矿石(沥青铀矿)中发现并分离出镭元素,激发了人们对铀矿进行开采,将提取出的镭制成萤光油漆,用于钟表和飞机仪表盘上。 由于要处理3吨铀矿才能提取出1克镭,这产生了大量的含铀副产品。这些副产品都送往彩釉工业,使得含铀彩釉的价格大大降低。除了陶器以外,铀还被用在瓦片中,可制成红、蓝、绿、黄、紫红、黑等多种颜色。

铀玻璃为真空电容密封。
铀也被用在摄影学化学物(特别是用作调色剂的硝酸铀)、 灯丝以及皮革、木材的染料当中。铀盐可作为丝绸和样貌的媒染剂。乙酸铀酰和甲酸铀酰在透射电子显微镜中被用作富含电子的染料,在为超薄切片、单独细胞器和高分子成像时,及在对病毒进行负染色法时提高标本与环境的对比度。
铀的放射性的发现促进了更多在科学及日常中对铀的应用。由于铀-238同位素的半衰期很高(4.51×10 年),因此被用来估计最远古火成岩的年龄。其他用到铀的放射性定年法包括铀钍定年法、铀铅定年法和铀铀定年法。在产生高能X射线时所用的目标体中也用到铀。
历史
史前天然裂变
1972年,法国物理学家 弗朗西斯·佩兰 ( 英语 : Francis Perrin ) 分别在西非加蓬奥克洛的3个矿床中,发现了15处古天然核反应堆,今天已不再活跃。该矿床的年龄为17亿年,当时地球上的铀中,铀-235占3%。 在适当环境下,这足以激发并维持核连锁反应。
史前应用
人类最早使用铀的天然氧化物,可以追溯到公元79年以前。当时氧化铀被用来为陶瓷上黄色的彩釉。 1912年,牛津大学的R. T. Gunther在意大利那不勒斯湾波希里坡海角(Cape Posillipo)的古罗马别墅中,发现了含1%氧化铀的黄色玻璃。 从欧洲中世纪晚期开始,波希米亚约阿希姆斯塔尔(既今捷克亚希莫夫)的居民就使用哈布斯堡银矿中提取的沥青铀矿来制造玻璃。 19世纪初,人们所知的铀矿仅在以上的地点。
发现
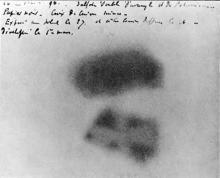
亨利·贝可勒尔在1896年将照相底片放在铀附近,从而发现了放射性。
铀元素是由德国化学家马丁·克拉普罗特发现的。1789年,他在位于柏林的实验室中,把沥青铀矿溶解在硝酸中,再用氢氧化钠中和,成功沉淀出一种黄色化合物(可能是 重铀酸钠 ( 英语 : Sodium diuranate ) )。 克拉普罗特假设这是一种未知元素的氧化物,并用炭进行加热,得出黑色的粉末。他错误地认为这就是新发现的元素,但其实该粉末才是铀的氧化物。 他以威廉·赫歇尔在八年前发现的天王星(Uranus)来命名这种新元素,而天王星本身是以希腊神话中的天神乌拉诺斯命名的。同样地,铀之后的镎(Neptunium)以海王星(Neptune)命名,其后的钚(Plutonium)则以冥王星(Pluto)命名。
1841年,巴黎中央工艺学校(Conservatoire National des Arts et Métiers)分析化学教授 尤金-梅尔希奥·皮里哥 ( 英语 : Eugène-Melchior Péligot ) 把四氯化铀和钾一同加热,首次分离出铀金属。 19世纪时人们不意识到铀的危险性,因此发展了各种铀的日常应用,其中包括历史流传下来的陶瓷和玻璃上色。
1896年,亨利·贝可勒尔在位于巴黎的实验室中,使用铀元素发现了放射性。 贝可勒尔将硫酸铀钾盐(K 2 UO 2 (SO 4 ) 2 )放在底片上,并置于抽屉当中。取出之后,他发觉底片出现了雾状影像。 他得出结论,铀会发出一种不可见光或射线,在底片上留下了影像。
核裂变研究

曼哈顿计划期间制造的铀立方体
以恩里科·费米为首的一个团队在1934年观察到,对铀进行中子撞击会产生β射线(即释放出电子或正子)。 这些裂变产物起初被误以为是原子序为93和94的新元素,它们分别被命名为Ausonium和Hesperium。 奥托·哈恩和 弗里德里希·史特拉斯曼 ( 英语 : Fritz Strassmann ) 在哈恩位于柏林的实验室中进行了此项实验,发现了铀能够分裂成为更小的原子核,并释放出核结合能。 莉泽·迈特纳和她的侄子奥托·罗伯特·弗里施于1939年2月刊登了该现象的物理解释,并将这种过程称为“核裂变”。 不久之后,费米猜测铀的裂变所释放的中子可能足以使这一裂变持续进行。1939年,这一假说得到了证实。科学家也发现,占少数的铀-235同位素每次裂变平均可产生2.5个中子; 而占多数的铀-238则可经核嬗变变为钚,而钚就像铀-235一样,能够进行释放热中子的核裂变。这一发现促使多国开始进行制造核武器及运用核能的相关研究。
1942年9月2日,美国曼哈顿计划中同样以费米为首的另一团队成功产生了首次人造核连锁反应,称Chicago Pile-1。团队在芝加哥大学一个美式足球场地底进行此项实验,其中使用了360吨石墨、53吨氧化铀和5.5吨铀金属。
原子弹

在代号为“小男孩”的铀原子弹爆炸之后,日本广岛上空所出现的蘑菇云
第二次世界大战,美国主要研发了两种原子弹:一种主要含铀的炸弹,其中的可裂变物质为高浓缩铀(代号“小男孩”);另一种为主要含钚的炸弹,其钚元素源自铀-238(见三位一体核试及胖子原子弹)。“小男孩”是首个被用于战争当中的核武器,它在1945年8月6日于日本广岛上空爆炸。其爆炸当量为12,500吨TNT炸药,引爆后的热冲击波摧毁了5万幢房屋,导致7.5万人死亡。(见广岛与长崎原子弹爆炸)。 起初人们以为铀是一种稀有元素,通过垄断所有现有铀存库便可避免核扩散。然而不过10年,大型铀矿就在世界各地相继被发现。
反应堆

首个人造核能发电机EBR-I(实验增殖反应堆一号)所点亮的4个灯泡(1951年)
位于美国田纳西州橡树岭国家实验室的X-10石墨反应堆是世界上第二个人造核反应堆 ,也是第一个为持续作业而造的核反应堆。爱达荷州阿科镇阿贡国家实验室的EBR-I(实验增殖反应堆一号)在1951年12月20日成为了首个产生电力的核反应堆。 最初该反应堆只点亮了4个150瓦灯泡,但经过改进,它最终可为整个实验室供电。(其后,阿科镇成为了世界上首个完全依赖核电的小镇,其电力来自阿贡国家实验室的另一个核能发电机BORAX-III。) 全球首个商业规模核电厂是位于前苏联的奥布宁斯克核电站,它于1954年6月27日投入使用。1954年,鹦鹉螺号成为了第一个使用核动力的潜水艇。
核污染及冷战后患
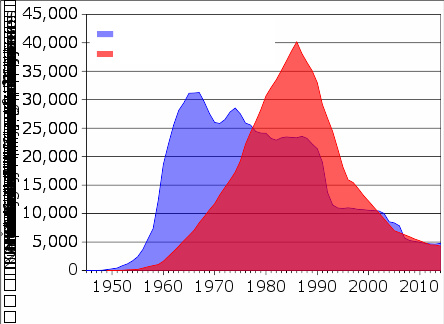
美国(蓝)与苏联(红,后俄罗斯联邦)从1945年至2017年的核武器积存量
苏联及美国在1950年代至1960年代初,以及法国在1970至1980年代所进行的地面核试验 使大量含有铀的子同位素的辐射落尘散布在世界各地。 多次核事故也加剧了放射性污染。
铀矿工人患癌症的机会比其他人较高。例如,有证据显示纳瓦霍铀矿工人有较高机会患肺癌。 美国1990年通过的辐射曝露补偿法规定,对所有确诊患有癌症或其他呼吸道疾病的铀矿工人给予10万美元慰问金。
美苏冷战期间,两国收集并囤积了大量的铀,并用此制造了上万个核武器。在1991年苏联解体之后,540吨武器级高浓缩铀(足以制成4万个核弹头)被存放在监管不严的地点,散布在俄罗斯联邦及其他前苏联国家。 亚洲、欧洲及南美洲各国警方在1993年和2005年之间,至少有16次截获到走私的武器级铀和钚,大部分都来自前苏联。 美国在1993年至2005进行了材料保护、控制和衡算项目,动用了5.5亿美元来保护位于俄罗斯的铀钚存库。 《科学美国人》在2006年2月刊登文章,指出其中一处设施在改善项目进行之前,浓缩铀是存放在扫帚柜的,用来记录核弹头的卡片则放在鞋盒中。
存量
生物及非生物存量

沥青铀矿是最常用来提取铀的矿石。
铀是一种天然元素,在各类岩石、土壤和水里都会少量出现。在地球的地壳当中,铀的丰度在所有元素中排列第51。铀也是在地球上大量存在的元素中原子序最高的。与所有原子量大于铁的元素一样,铀只能在超新星爆炸中自然产生。 地幔的热量主要来自当中铀、钍和钾-40的衰变。 这一热量使得地球的外核保持液态,也推动着地幔对流,从而导致板块移动。
铀在地壳中的平均含量为百万分之2至4, 约为银的40倍。 从地表至地底25公里一层内,估计含有10 kg铀,而海洋里则可能有10 kg铀。 泥土中铀的含量为百万分之0.7至11(由于使用磷肥料,农田土壤中铀浓度可高达百万分之15),在海中则是十亿分之3。
铀的含量比锑、锡、镉、汞和银要高,并和砷和钼相约。 数百种矿石都含有铀,如沥青铀矿(最常见的铀矿石)、钒酸钾铀矿、钙铀云母、硅钙铀矿、铜铀云母、水硅铀矿等等。 一些其他物质里也有明显较高的铀含量,如磷矿石、褐煤、独居石等。 一些加工厂能够从含铀量低至0.1%的物质中提取出铀。
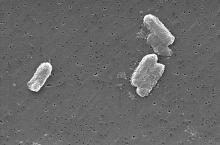
柠檬酸杆菌中的铀浓度可以比周围环境高出300倍。
腐败希瓦菌和铁还原地杆菌等的某些细菌可以将铀(VI)还原成铀(IV)。 某些生物,如地衣Trapelia involuta和微生物柠檬酸杆菌能够使内部铀浓度比周围环境高300倍。 柠檬酸杆菌在甘油磷酸(或其他类似的有机磷酸化合物)存在的情况下,可吸收铀酰离子。在一天以后,一克细菌可以产生9克磷酸铀酰晶体。这意味着可以用这一些物种对受到核污染的水源进行生物修复。
自然界中的铀(VI)在碱性环境下会形成可溶性很高的碳酸盐配合物。这使得核废料中的铀能够轻易流动至地下水源和泥土中,对环境造成污染破坏。然而在碱性环境下,当存在过量碳酸盐时,很难将铀以磷酸铀的形式沉淀出来。
植物会从泥土中吸取部分铀。如果去水后以重量计,那铀在植物中的含量为十亿分之5至60,而木材燃烧后的灰烬中可含有百万分之4的铀。 食用植物中,铀的去水重量比一般较低。人类每天从食物中吸收1至2微克的铀。
采矿与生产
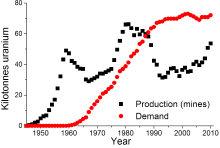
全球铀矿及铀需求分布图

黄饼是一种经过提炼的高浓度氧化铀混合物
2010年世界铀产量为53,663吨,其中17,803吨(33.2%)采自哈萨克斯坦。其他主要铀生产国还包括:加拿大(9,783吨)、澳洲(5,900吨)、纳米比亚(4,496吨)、尼日尔(4,198吨)和俄罗斯(3,562吨)。
开采铀矿的方法包括:露天开采、地下开采、原地浸出和钻孔开采等。 开采出的低浓度铀矿包括0.01至0.25%的氧化铀,经复杂的过程可从中提炼出铀金属。 采自加拿大萨斯喀彻温阿萨巴斯卡盆地矿藏的高浓度铀平均可含有高达23%的氧化铀。 铀矿石要压碎至粉末状,再经酸或碱浸滤。浸滤液需通过沉淀、溶液萃取和离子交换,形成一种称为“黄饼”的铀精矿,含有至少75%氧化铀(U 3 O 8 )。黄饼要经煆烧以移除磨粉过程中的杂质,再送往精炼和化学转换工序。
用碱金属或碱土金属对卤化铀进行还原反应,可制成商用铀。 KUF 5 或UF 4点解后,溶于熔化的氯化钙( CaCl 2 )和氯化钠(NaCl)溶液中,也可产生铀金属。 卤化铀放在热灯丝上经热降解,可形成高纯度铀。
资源储备
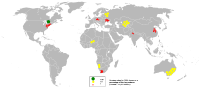
2005年全球主要铀矿分布图
经估计,全球目前有550万吨铀库存,每磅铀可售59美元; 另有3500万吨铀尚待开采。 铀价格从2003年5月的每磅10美元升至2007年7月的每磅138美元。这促使了人们对铀的开采: 2005年世界为铀开采花费2亿美元,比2004年高出54%; 2006年世界花费7.74亿美元,比2004年高出250%。
澳洲拥有全球已知铀矿藏的31%。 世界上最大的单个铀矿藏并位于南澳州的奥林匹克大坝矿山。 中非共和国姆博穆省贝库玛也拥有大型铀矿藏。
“百万吨变百万千瓦”等类似计划通过拆卸核武器,将可用物质转变为核燃料。
海水中估计仍含有46亿吨铀。1960年代后期,中国华东师范大学在世界上首次从海水中提取出公斤级的铀。 1980年代,日本科学家证明,用离子交换法从海水萃取铀元素在技术上是可行的。 科学家曾进行从海水中提取铀的实验, 但由于水中含有碳酸盐,使铀产量很低。2012年,美国橡树岭国家实验室的研究人员宣布成功研发了一种称为HiCap的新型吸附剂,能比过去的吸附剂更好地保留固体或气体分子、原子和离子。研究人员称,这种材料提取出的铀比过去多5至7倍。
供应
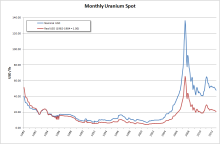
每月铀价格趋势图(以每磅美元计),2007年的铀价泡沫爆破清晰可见。
2005年共有17个国家生产高浓度氧化铀,其中哈萨克斯坦(占全球产量的35.6%)和加拿大(16.7%)为最大产国,其他主要产国还包括澳洲(11.0%)、尼日尔(8.0%)、纳米比亚(6.0%)、乌兹别克斯坦(5.5%)、俄罗斯(5.5%)、阿根廷(2.1%)、美国(2.8%)及中国(2.7%)等。 2004年国际原子能机构预计地球上的所有铀矿藏估计足够供应未来85年的需求, 但也有研究指出,20世纪末投资不足,可能对21世纪的铀供应带来压力。 铀矿藏量与矿石含铀量呈对数正态分布。矿石含铀量降低10倍,可开采的铀矿量就会提高300倍。 也就是说,矿石含铀量越高,可开采量则越低,反之亦然。
化合物
氧化态与氧化物
氧化物
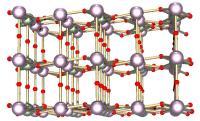
八氧化三铀(左)和二氧化铀(右)是最常见的两种氧化铀。
大型铀加工厂所煆烧出的黄饼含有不同的铀化合物,其中有铀的各种氧化态。氧化态较低的粒子在煆烧炉中存留时间较短,氧化态较高的存留时间则较长。含铀物质一般假设为 U 3 O 8 ,比如曼哈顿计划中进行化学分析时,都以 U 3 O 8 作为计算的标准。
氧铀系统中物质的相态非常复杂。铀的最常见氧化态为铀(IV)和铀(VI),分别对应于二氧化铀( UO 2 )和三氧化铀( UO 3 )。 其他存在的氧化物还有一氧化铀(UO)、五氧化二铀( U 2 O 5 )、过氧化铀( UO 4 ·2H 2 O )等等。
八氧化三铀( U 3 O 8 )和二氧化铀( UO 2 )是铀最常见的氧化物。这两种氧化物都是固体,不易溶于水,在许多化学环境下都相对稳定。八氧化三铀是最稳定的铀氧化物,也是自然界中最常见的一种。二氧化铀则是核反应堆中最常用的铀燃料。在环境温度下, UO 2 会逐渐转变为 U 3 O 8 。因为铀的氧化物都较稳定,所以铀是以氧化物的形态储存和弃置的。
水溶化学

左至右为铀的III、IV、V、VI氧化态
铀具有不同氧化态的盐,当中不少都溶于水,可在水溶液中进行研究。铀的最常见离子态为 U (棕红色)、 U (绿色)、 UO + 2 (不稳定)及 UO 2+ 2 (黄色),分别对应于U(III)、U(IV)、U(V)和U(VI)。 铀(II)氧化态有UO和US等固态及半金属化合物,但没有可溶的简单离子。 U 离子不稳定,会从水中释放出氢气。铀(VI)态对应 UO 2+ 2 离子,有碳酸铀酰、氯化铀酰和硫酸铀酰等化合物。 UO 2+ 2 能和各种有机螯合剂形成配合物,其中醋酸铀酰最为常见。
各种铀酰和氧化铀阳离子都可溶于水,但铀酸盐并不溶于水 。
碳酸盐
当铀(VI)溶于碳酸盐溶液而非纯水中时,其普尔贝图会因与碳酸离子的交互作用而有很大的变化。虽然大部分碳酸盐都不溶于水,但碳酸铀却是可溶的。这是由于铀(VI)阳离子可以与两个氧化物及至少三个碳酸盐形成阴离子配合物。
酸碱度的影响
从铀的化学形态比例图可以推论,铀(VI)溶液的pH值提升,会使铀形成水合氢氧化氧铀,并在高pH值时形成氢氧化配合物阴离子。
当加入碳酸盐后,pH值的提高会使铀转化为一系列的碳酸盐配合物形态。特别在pH在6至8的时候,铀的可溶性会提高,这有助长期稳定储藏乏核燃料中的氧化铀。
氢化物、碳化物及氮化物
铀金属在加热至250到300摄氏度时,会与氢反应,形成氢化铀。继续加热则会再次去除氢。因此氢化铀可用于制造铀的各种碳化物、氮化物和卤化物。 氢化铀具有两种晶体相态:α型存在于低温环境下,β型则在250 °C以上出现。
碳化铀与氮化铀都是相对惰性的半金属物质,能少许溶于酸中,并会与水反应及在空气中燃点形成 U 3 O 8 。 铀的碳化物包括一碳化铀(UC)、二碳化铀( UC 2 )和三碳化二铀( U 2 C 3 )。向熔化铀加入碳,或在高温下把铀金属置于一氧化碳中,可产生UC和 UC 2 。 U 2 C 3 在1800 °C以下稳定,通过对UC和 UC 2 的混合物进行机械施压可以形成。 铀金属在直接接触氮后所形成的氮化铀包括:一氮化铀(UN)、二氮化铀( UN 2 )及三氮化二铀( U 2 N 3 )。
卤化物

六氟化铀是铀-235分离过程中所用到的铀原料。
所有的氟化铀都是从四氟化铀( UF 4 )转化而成的, UF 4 则由二氧化铀经氢氟化反应形成。 UF 4 与氢在1000 °C反应后,会还原成三氟化铀( UF 3 )。在适当的温度和压力下,固态 UF 4 与气态六氟化铀( UF 6 )反应后,可产生氧化态介乎两者之间的氟化物: U 2 F 9 、 U 4 F 17 和 UF 5 。
在室温底下, UF 6 具有高蒸气压,这有助于用气体扩散法把铀-235从比例更高的铀-238同位素中分离出来。通过以下反应,二氧化铀和氢化铀就能形成六氟化铀。
所形成的 UF 6 是一种白色固体,化学活性极高(进行氟化反应),容易升华(其气态接近理想气体)。它是已知的铀化合物中挥发性最强的。
要制造四氯化铀( UCl 4 ),可以直接将氯与铀金属或氢化铀结合。如果用氢还原 UCl 4 ,可产生三氯化铀( UCl 3 );进一步进行氯化反应,则可产生氧化态更高的氯化铀。 所有氯化铀都能与水和空气反应。
铀的溴化物和碘化物可通过将铀直接与溴或碘反应形成,或在氢溴酸或氢碘酸中加入 UH 3 。 这些化合物有 UBr 3 、 UBr 4 、 UI 3 和 UI 4 等等。铀的氧卤化物均可溶于水,例如 UO 2 F 2 、 UOCl 2 、 UO 2 Cl 2 和 UO 2 Br 2 。卤素的原子量越高,对应的氧卤化物稳定性就越低。
同位素
自然丰度
天然铀元素铀三种主要同位素组成:铀-238(丰度为99.28%)、铀-235(0.71%)和铀-234(0.0054%)。它们均具有放射性,会释放α粒子,但也有较小机会进行自发裂变。
铀-238是最稳定的铀同位素,半衰期约为4.468×10 年,与地球的年龄相约。铀-235的半衰期约为7.13×10 年,而铀-234的半衰期则约为2.48×10 年。 天然铀所释放出的α粒子中,49%来自 U,同样有49%来自 U,最后约2.0%来自 U。地球刚刚形成的时候,约有五分之一的铀是铀-235,而 U的丰度则很可能比今天低得多。
铀-238通常释放α粒子(有时也会进行自发裂变),其衰变链被称为铀衰变系。该衰变系包含18种原子核,最后一种是铅-206,整个衰变链由多种衰变途径组成。
同位素 U的衰变系被称为锕衰变系,其中有15种原子核,最后一种是铅-207。 由于这些衰变系的衰变速率是不变的,因此有助于对比母子原子核的丰度,从而进行放射性定年法。
铀-234也属于铀衰变系,因此它会最终衰变为铅-206。
铀-233是通过在核反应堆中对钍-232进行中子撞击而形成的。 U是可裂变物质, 其衰变系的最后一种核素为铊-205。
铀-235在核反应堆和核武器中有着十分重要的作用,因为它是自然界中唯一一种大量存在的可裂变铀同位素。它能够在热中子撞击下,分裂成多个碎片,从中释放出可用的能量。
铀-238不可裂变,但则是可转换同位素,能够经中子活化变为可裂变的钚-239。铀-238可吸收一颗中子,形成铀-239。 U会经β衰变成为镎-239,并在几天内再β衰变为钚-239。 Pu是三位一体核试中世界首个原子弹所使用的可裂变物质。
浓缩铀

一排排用来浓缩可裂变铀同位素的气体离心机。
自然界中的铀是由99.2742%的铀-238和0.7204%的铀-235组成的。同位素分离过程将可裂变的铀-235的浓度提高,以产生核武器和发电所用的浓缩铀。铀-235原子裂变所释放的中子会被其他铀-235原子吸收,促发更多的裂变反应,持续核连锁反应。达到核连锁反应所需的铀-235质量称为临界质量。
浓缩铀的铀-235含量一般介乎3%到5%。 浓缩过程会产生大量不含铀-235的物质,称为贫铀。贫铀中铀-235的含量不超过0.3%。 铀的价格从2001年至2007年不断上升,使铀-235含量超过0.35%的铀重新进行浓缩过程。贫六氟化铀的价格因此从2001的每公斤5美元升至2007年的130美元以上。
最常用的铀浓缩方法是气体离心法,即利用 UF 6 和 UF 6 分子量上的差异,把含有铀-235的六氟化铀离心分离出来。 气体扩散法是人们最先使用的浓缩方法,曾用于美国曼哈顿计划。该方法将六氟化铀重复透过银锌薄膜扩散,利用同位素间扩散率的不同分离出铀-235(铀-238的原子量更高,因此扩散率较低)。 分子激光同位素分离法用具有特定能量的激光束把铀-235与氯之间的分子键断开,但保留铀-238与氯间的键合。铀-235便能以金属态从溶液中沉淀分离出来。 原子蒸气激光同位素分离法(AVLIS)使用的则是发出可见光的可调激光器,如染料激光器等。 另一种浓缩方法为液态热扩散发。
安全
人类吸入受污染空气或摄入受污染的水和食物,铀(及其衰变产物,如氡等)就会进入人的体内。空气中的铀通常非常少,但在磷化肥处理厂、核武器研究中心、煤发电厂、铀矿、铀矿石和浓缩铀处理厂中工作的人员,以及居住在曾使用贫铀作为武器的战地附近的人,就会有较高的铀摄入量。 位于地底铀矿藏上的房屋建筑中会有较多的放射性氡气。
大部分进食到体内的铀会在消化过程后排出。当氧化铀等不可溶的含铀物质进入身体后,只有大约0.5%会被吸收;如果可溶性较高的铀酰离子进入体内,身体所吸收的量可以高达5%。 不过,可溶的比不可溶的铀化合物能够更快地离开身体,特别是当不可溶铀化合物经尘埃进入肺部之后,会对人体造成更大的伤害。在进入血液后,铀会因亲磷性而积累在骨骼组织内,并停留多年。 人的皮肤不会吸收铀,且铀所释放的α粒子也无法穿透皮肤。
影响
留在体内的铀会影响肾、脑、肝、心的正常运作,其本身的化学毒性也会对身体的其他器官造成伤害。 铀是一种生殖毒物。 因为铀释放的α辐射具有较小的穿透范围,所以放射性只会对小部分组织造成影响。三氧化铀、硝酸铀酰及其他六价铀化合物中的铀酰( UO 2+ 2 )离子在实验动物身上,造成了先天缺陷和免疫系统破坏。 美国疾病控制与预防中心曾发表过研究指出,天然及贫铀仍没有造成过人类癌症个案, 但是有充分证据证明铀及其衰变产物(特别是氡)对人体健康有极大的威胁。 铀金属粉末可以在室温下在空气中自燃,造成火灾。
研究人员在接触铀金属时,都会使用手套作保护。 在处理及存放含铀度高的物质时,须避免意外摄入。
参见
各国铀储备量列表
核工程
核燃料循环
原子核物理学
参考文献
书籍
Emsley, John. Uranium.Nature"s Building Blocks: An A to Z Guide to the Elements. Oxford: Oxford University Press. 2001: 476–482. ISBN 0-19-850340-7.
Seaborg, Glenn T. Uranium. The Encyclopedia of the Chemical Elements. Skokie, Illinois: Reinhold Book Corporation. 1968: 773–786. LCCCN 68-29938.
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

- 有价值
- 一般般
- 没价值








24小时热门
推荐阅读

知识互答
关于我们

APP下载


























{{item.time}} {{item.replyListShow ? '收起' : '展开'}}评论 {{curReplyId == item.id ? '取消回复' : '回复'}}