烷烃
性质概论
烷类皆难溶于水,在完全燃烧下可转化为二氧化碳和水 ,反应式如下:
烷类会因组合 结构 的不同,其性质可能会有极大的差异。若结构相似,则性质相近;若结构不同,性质不同。 正因此,烷类种类繁多;但也由此许多化学式相同的物质,其性质不相同。如戊烷( C 5 H 12 ) :
物理性质
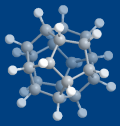
人工合成的正十二面体烷C 20 H 20
烷烃有许多物理性质:
密度皆小于一。
不溶于水,但溶于有机溶剂。
熔点与沸点随著分子量增大和碳链增长而升高,同碳数的烷烃,支链越多沸点越低。
一般情况下,碳数小于5的烷类(甲烷到丁烷)为气态,5-17之间的烷类(戊烷到十七烷)为液态,18个碳(十八烷)以上的烷类为固态。
化学性质
在正常情况下,烷烃性质很稳定,因为碳-氢键和碳-碳键相对稳定,难以断裂 、以及烷烃不会抢夺官能团,所以不容易发生反应,除了下面三种反应,小分子的烷烃几乎不能进行其他反应。但支链多的烷烃,键角可能不同于 arccos --> ( − − --> 1 3 ) {\displaystyle \arccos \left(-{1 \over 3}\right)} 即109.5度,导致其容易发生反应。
燃烧反应
反应通式: R + O 2 → → --> C O 2 + H 2 O {\displaystyle {\rm {R+O_{2}\rightarrow CO_{2}+H_{2}O}}} 所有的烷烃都能燃烧,而且反应放热极多。 烷烃完全燃烧生成CO 2和H 2 O 。如果O 2 的量不足,就会产生有毒气体一氧化碳(CO),甚至炭黑(C)。
以甲烷为例:
CH 4 + 2 O 2 → CO 2 + 2 H 2 O
O 2 供应不足时,反应如下:
2CH 4 + 3 O 2 → 2CO + 4 H 2 O
CH 4 + O 2 → C + 2 H 2 O
分子量大的烷烃经常不能够完全燃烧,它们在燃烧时会有黑烟产生,就是炭黑。
卤代反应
反应通式: R + X 2 → → --> R X + H X {\displaystyle {\rm {R+X_{2}\rightarrow RX+HX}}} 由于烷烃的结构太牢固,一般的有机反应不能进行。烷烃的卤代反应自由种自由基取代反应,反应的起始需要光能来产生自由基。
以下是甲烷被卤代的步骤。这个高度放热的反应可以引起爆炸。
链引发阶段:在紫外线的催化下形成两个Cl的自由基
链增长阶段:一个H原子从甲烷中脱离;CH 3 Cl开始形成。
链终止阶段:两个自由基重新组合
裂解反应
裂化反应是大分子烃在高温、高压或有催化剂的条件下,分裂成小分子烃的过程。裂化反应属于消除反应,因此烷烃的裂化总是生成烯烃。如十六烷(C 16 H 34 )经裂化可得到辛烷(C 8 H 18 )和辛烯(C 8 H 16 )。
由于每个键的环境不同,断裂的机率也就不同,下面以丁烷的裂化为例讨论这一点:
CH 3 -CH 2 -CH 2 -CH 3 → CH 4 + CH 2 =CH-CH 3
CH 3 -CH 2 -CH 2 -CH 3 → CH 3 -CH 3 + CH 2 =CH 2
CH 3 -CH 2 -CH 2 -CH 3 → CH 2 =CH-CH 2 -CH 3 + H 2
裂化反应中,不同的条件能引发不同的机理,但反应过程类似。热分解过程中有碳自由基产生,催化裂化过程中产生碳正离子和氢负离子。这些极不稳定的中间体经过重排、键的断裂、氢的转移等步骤形成稳定的小分子烃。
在工业中,深度的裂化叫做裂解,裂解的产物都是气体,称为裂解气。
命名
烷类的命名多采IUPAC命名法。 命名烷类的首要步骤是分析其为环状亦或是链状,再进行命名步骤。
链烷烃
化学通式: C n H 2n+2 链烷烃的命名步骤为:
找出最长的碳链当主链,依碳数命名主链,前十个以天干 代表碳数,碳数多于十个时,以中文数字命名,如:十一烷。
从最近的取代基位置编号:1、2、3...(使取代基的位置数字越小越好)。以数字代表取代基的位置。数字与中文数字之间以 - 隔开。
有多个取代基时,以取代基数字最小且最长的碳链当主链,并依甲基、乙基、丙基的顺序列出所有取代基。
有两个以上的取代基相同时,在取代基前面加入中文数字:一、二、三...,如:二甲基,其位置以“,”(逗号)隔开,一起列于取代基前面。
因为烷类一般简单,故亦会使用“正、异、新”去区隔同样化学式的烷类。IUPAC也曾推荐过此种命名方式 。如例己烷命名方式:
环烷烃
化学通式: C n H 2(n+1-g) 简单的环烷烃的命名方式基本上和烷类方式相同,仅需在前添加一环字,以做识别。如例环丙烷:
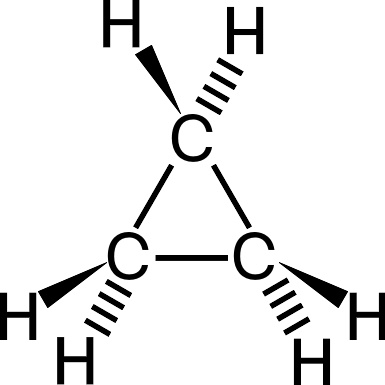
环丙烷,化学式为 C 3 H 6
具多环的环烷烃的命名法
除非有俗名,否则具多环的环烷烃如桥环烷烃及螺环烷烃的命名较为复杂。名字包括表示环数量的前缀(如“二环”)、各环内碳原子总数的后缀以及表示各端点之间碳原子数的数字前缀(表示于中括号内。多个环公用的碳原子,即桥头碳不计入内)。 如例一、例二:
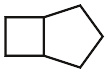
例一,二环[3.2.0]庚烷。
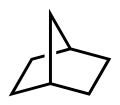
例二,双环[2.2.1]庚烷(俗称降冰片烷)
这个环烷总碳数为七,由两个环组成,尾为“庚烷”,头为“双环”。两个被共用的碳原子间有三个连接路线:一为五元环的部分,共三个碳(两个桥头碳不计入内,下同);二为四元环的部分,共二个碳;三为两环之间共用的边线,只由两桥头碳直接连结,中间没有碳。由此得出中括号内的数字(以降序表示数字之间用点分隔),[3.2.0]。故上图的环烷名为二环[3.2.0]庚烷,而数字的个数总比环数多一个(在此有两个环及三个数字)。“[3.2.0]二环庚烷”亦可接受,但环上有取代基时“二环[3.2.0]庚烷”有保留前面的位置的好处,方便加上其他含数字的前缀,以符合IUPAC命名常规。
上图环烷总碳数为七,全为单键,词尾为庚烷;两共用碳间有两对二碳碳链,也被一个碳原子连接着,故词尾之前的数字前缀为[2,2,1](共用碳不计入内);这个环烷由两个环组成,故前缀为“双环”,最后得出“双环[2.2.1]庚烷”。
特例
出于化工习惯,异辛烷不是2-甲基庚烷,而是2,2,4-三甲基戊烷。
结构
烷烃中,每个碳原子都是四价的,采用sp 杂化轨道,与周围的4个碳或氢原子形成牢固的σ键,可以旋转,故烷类无顺反异构物。 为了使键的排斥力最小,连接在同一个碳上的四个原子形成四面体。甲烷是标准的正四面体形态,其键角为 a r c c o s ( − − --> 1 3 ) {\displaystyle arccos(-{1 \over 3})} ,大约等于109°28′。 下面是前10种直链烷烃的分子式和结构模型图。
异构体
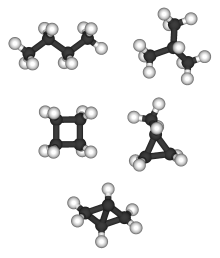
不同的四碳烃类(从左到右):正丁烷和异丁烷为同分异构体,化学式皆为C 4 H 10 ;环丁烷和异丁烯为同分异构体,化学式皆为C 4 H 8 双环[1.1.0]丁烷是唯一化学式为C 4 H 6 的烷烃。
烷类的异构物大多链异构(由于支链不同而造成的异构物)。超过3个碳原子的烷烃可以以多种方式排列,形成同分异构体。烷烃异构物的数目会随着碳数增加而增加(OEIS中的数列A000602) 。
链烷烃的异构体
C 1 :没有同分异构体:甲烷
C 2 :没有同分异构体:乙烷
C 3 :没有同分异构体:丙烷
C 4 :两个异构体:正丁烷,异丁烷
C 5 :三个异构体:正戊烷,异戊烷,新戊烷
C 6 :五个异构体:己烷
C 12 :三百五十五个异构体
C 32 : 27,711,253,769个异构体
C 60 : 22,158,734,535,770,411,074,184个异构体,其中有很多为非稳定状态。
分布

烷烃是木星大气层的主要成分
烷烃在宇宙间分布众多,其中分布最多的是甲烷,而极少见由50个碳原子以上所构成的烷烃 。
太阳系的分布
烷烃分布于太阳系间许多星球的大气层。有些占了较多的比例,例如天王星(2.3%) 、土卫六(5%) ,但在大多星球上,分布较少,如地球、火星、土星等等 。
地球上的分布
地球上的烷烃多为甲烷,而甲烷的浓度随地球纬度降低而递减,并在北纬40度及赤道附近都有明显浓度下降。北半球与南半球平均浓度各为1.65ppm及1.55ppm。
应用
工业上的应用
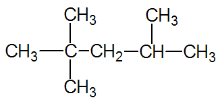
异辛烷(2,2,4-三甲基戊烷)的结构式。
由于烷烃的制取成本较高(一般要用烯烃催化加氢),所以在工业上不制取烷烃,而是直接从石油中提取。由于烷烃不易发生反应,所以工业上也不把它作为化工基本原料。烷烃的作用主要是做燃料。天然气和沼气(主要成分为甲烷)是近来广泛使用的清洁能源。
由于烷烃大多来自于石油,所以必须经过分馏的过程,以得到各种不同用途的烷烃类。 分馏结果大约如下:
C 20 以上的馏分成分是重油,再经减压蒸馏能得到润滑油、沥青等物质。
其他
异辛烷与庚烷是汽油抗爆震度的一个标准,其辛烷值定为100与0。
参看
环烷烃
烯烃-炔烃
烷基
官能团
裂化
烃
延伸阅读
Virtual Textbook of Organic Chemistry
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

- 有价值
- 一般般
- 没价值








24小时热门
推荐阅读
知识互答
关于我们

APP下载
























{{item.time}} {{item.replyListShow ? '收起' : '展开'}}评论 {{curReplyId == item.id ? '取消回复' : '回复'}}