



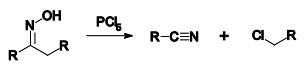
贝克曼重排反应
反应机理
根据推测,贝克曼重排的反应机理首先是烷基的迁移并推走羟基形成腈基基团,接下来该中间体被水解,形成产物酰胺。反应式如下:
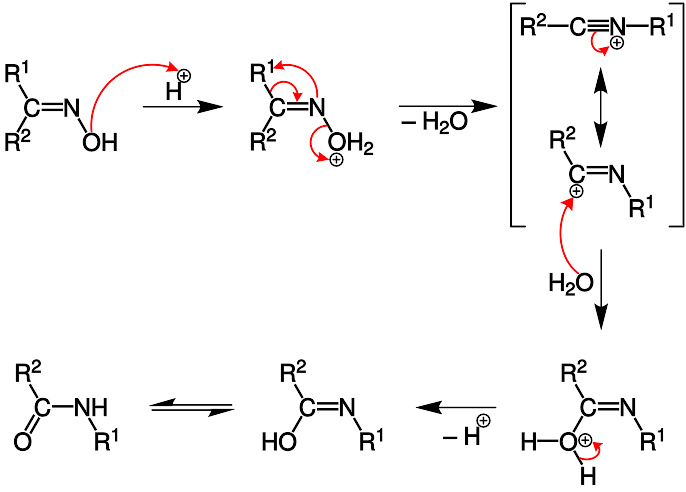
在一个研究中,研究者使用电脑模拟丙酮肟在贝克曼溶剂中的重排反应,并考虑到了溶剂分子和取代物的影响。模拟表明,有三个乙酸分子和一个质子(以氧鎓的形式存在)参与了反应。形成亚胺中间体后(σ配合物),甲基通过协同反应迁徙到氮上,并推走羟基。羟基中氧原子受到三个乙酸分子的稳定。接下来,一分子水进攻亲电的碳原子,其中一个氢原子被一个乙酸接收,生成的中间体为N-甲基乙酰氨酸,其中氧原子为四配位。最后异构化形成稳定的产物酰胺。

当计算对象是一个水合氢离子和六分子水的时候,结果相同。但是当移动基团为苯基的时候,例如在苯乙酮肟的重排反应中,反应更倾向于生成三元π-配合物。此配合物在对H3O(H2O)6的研究中没有发现。
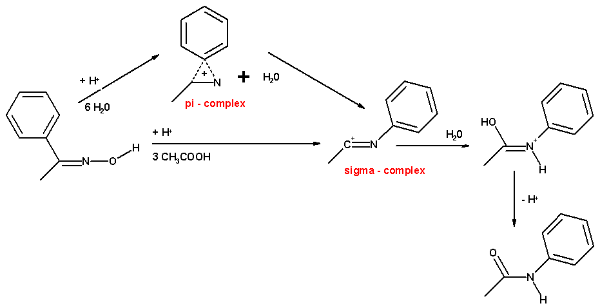
在环己酮肟的例子中,因为要释放环张力,所以有了第三种反应机理。它是通过一步协同反应步骤直接生成质子化的己内酰胺,而没有π-配合物或σ-配合物中间体。
氰尿酰氯辅助贝克曼反应
氰尿酰氯和氯化锌形成助催化剂可以催化贝克曼反应。例如:环十二酮能被平稳地转化为对定的内酰胺,后者是生产尼龙12的单体。
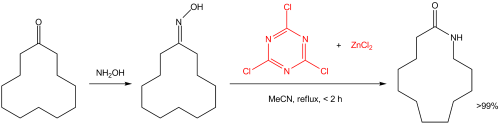
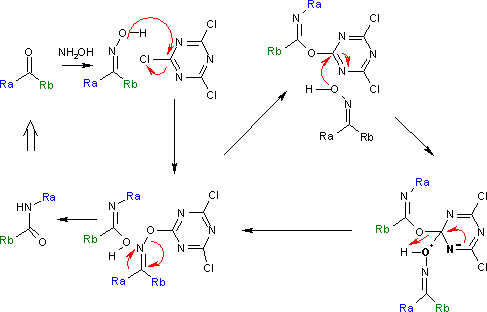
此反应的反应机理是以循环型催化为基础的,在循环中,氰尿酰氯通过亲核芳香取代活化羟基。通过Meisenheimer络合物中间体,最终生成产物。
异常贝克曼重排反应
α-二酮、α-酮酸、α-叔烃基酮(反式)、α-二烷基氨基酮、α-羟基酮和β-酮醚生成的肟在路易斯酸或质子酸的作用下断裂为腈及相应的官能团化合物。这个反应称为“异常贝克曼重排”,又称非正常贝克曼重排;二级贝克曼重排;贝克曼断裂反应等。
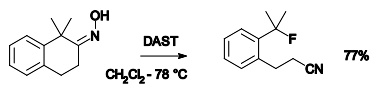
例如,如下 α-叔烃基酮肟生成腈鎓离子后,叔碳-碳键断裂,一部分生成腈,另一部分转变为碳正离子,碳正离子被二乙氨基三氟化硫(DAST)捕获,生成相应的氟代烃。
参见
Curtius重排
Dakin反应
Schmidt反应
Stieglitz重排反应
参考文献
^E. Beckmann. Zur Kenntniss der Isonitrosoverbindungen.Ber.1886, 19: 988–993. doi:10.1002/cber.188601901222.
^L. G. Donaruma, W. Z. Heldt. The Beckmann rearrangement.. Org. React. 1960, 11: 1–156. (综述)
^R. E. Gawley. The Beckmann reactions: rearrangement, elimination-additions, fragmentations, and rearrangement-cyclizations.. Org. React. 1988, 35: 14–24. (综述)
^J. C. Eck, C. S. Marvel.ε-BENZOYLAMINOCAPROIC ACID. Organic Syntheses, Coll. 1943, 2: 76.
^S. Yamabe, N. Tsuchida, S. Yamazaki.Is the Beckmann Rearrangement a Concerted or Stepwise Reaction? A Computational Study. J. Org. Chem. 2005, 70: 10638 – 10644. doi:10.1021/jo0508346.
^Y. Furuya, K. Ishihara, H. Yamamoto. [Cyanuric Chloride as a Mild and Active Beckmann Rearrangement Catalyst. J. Am. Chem. Soc. 2005, 127: 11240 –11241. doi:10.1021/ja053441x S0002-7863(05)03441-4 .
^Kirihara, Masayuki; Niimi, Kanako; Momose, Takefumi. Fluorinative -cleavage of cyclic ketoximes with diethylaminosulfur trifluoride: an efficient synthesis of fluorinated carbonitriles. Chemical Communications. 1997, 6: 599–600. doi:10.1039/a607749h.
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

- 有价值
- 一般般
- 没价值








24小时热门
推荐阅读
关于我们

APP下载



















