范托夫因子
溶质解离
溶质解离度是溶解于溶液中的溶质分子的比例。它通常用希腊字母阿尔法α α -->{\displaystyle \alpha }表示。这一系数和范托夫因子之间的关系很简单;如果α α -->{\displaystyle \alpha }比例的溶质解离为了n{\displaystyle n}个离子,那么,
例如,如下的电离方程,
产生了n=2{\displaystyle n=2}个离子,所以i=1+α α -->{\displaystyle i=1+\alpha }。
溶质缔合
类似的,如果n{\displaystyle n}摩尔的溶质中以α α -->{\displaystyle \alpha }比例缔合形成一个一摩尔微粒,那么
例如,乙酸在苯中的二聚作用,
两摩尔的乙酸缔合形成一摩尔物质,所以,
物理意义
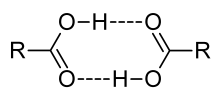
氢键导致了羧酸的二聚作用
若溶质微粒在溶液中缔合,i{\displaystyle i}值小于1,。例如各类羧酸或苯甲酸在苯中形成的二聚体,所以实际溶解的溶质微粒数是酸分子数的一半。
若溶质分子在溶液中离解,i{\displaystyle i}值大于1。例如氯化钠、氯化钾、氯化镁等强电解质溶于水中。
若溶质分子在溶解中既不离解也不缔合,i{\displaystyle i}值便等于1,例如葡萄糖溶于水中。
i{\displaystyle i}值等于:i{\displaystyle i} = 实际溶解的微粒数 ÷ 最初投入溶剂的微粒数。这表示平均算来,在稀溶液中,每单位化学式所溶解的微粒数。
参见
依数性
拉乌尔定律
范托夫方程
渗透压
参考资料
如何估算范托夫因子的值(How to determine the approximate van"t Hoff factor)(英文)
范托夫因子的相关计算(英文)
验证范托夫因子与溶液依数性性质的试验(英文)
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

- 有价值
- 一般般
- 没价值








24小时热门
推荐阅读
知识互答
关于我们

APP下载



























{{item.time}} {{item.replyListShow ? '收起' : '展开'}}评论 {{curReplyId == item.id ? '取消回复' : '回复'}}