



麦克斯韦-玻尔兹曼分布
麦克斯韦-玻尔兹曼分布的物理应用
麦克斯韦-玻尔兹曼分布形成了分子运动论的基础,它解释了许多基本的气体性质,包括压强和扩散。麦克斯韦-玻尔兹曼分布通常指气体中分子的速率的分布,但它还可以指分子的速度、动量,以及动量的大小的分布,每一个都有不同的概率分布函数,而它们都是联系在一起的。
麦克斯韦-玻尔兹曼分布可以用统计力学来推导(参见麦克斯韦-玻尔兹曼统计)。它对应于由大量不相互作用的粒子所组成、以碰撞为主的系统中最有可能的速率分布,其中量子效应可以忽略。由于气体中分子的相互作用一般都是相当小的,因此麦克斯韦-玻尔兹曼分布提供了气体状态的非常好的近似。
在许多情况下(例如非弹性碰撞),这些条件不适用。例如,在电离层和空间等离子体的物理学中,特别对电子而言,重组和碰撞激发(也就是辐射过程)是重要的。如果在这个情况下应用麦克斯韦-玻尔兹曼分布,就会得到错误的结果。另外一个不适用麦克斯韦-玻尔兹曼分布的情况,就是当气体的量子 热波长 ( 英语 : Thermal de Broglie wavelength ) 与粒子之间的距离相比不够小时,由于有显著的量子效应也不能使用麦克斯韦-玻尔兹曼分布。另外,由于它是基于非相对论的假设,因此麦克斯韦-玻尔兹曼分布不能做出分子的速度大于光速的概率为零的预言。
推导
麦克斯韦最初的推导假设了三个方向上的表现都相同,但后来在玻尔兹曼的一个推导中利用分子运动论去掉了这个假设。现在,麦克斯韦-玻尔兹曼分布可以轻易地从能量的玻尔兹曼分布推出:
其中 N i 是平衡温度 T 时,处于状态 i 的粒子数目,具有能量 E i 和简并度 g i , N 是系统中的总粒子数目, k 是玻尔兹曼常数。(注意有时在上面的方程中不写出简并度 g i 。在这个情况下,指标 i 将指定了一个单态,而不是具有相同能量 E i 的 g i 的多重态。)由于速度和速率与能量有关,因此方程1可以用来推出气体的温度和分子的速度之间的关系。这个方程中的分母称为正则配分函数。
动量矢量的分布
下列所述的推导,与詹姆斯·克拉克·麦克斯韦描述的推导和后来由维希·玻尔兹曼描述的具有较少假设的推导都有很大不同。它与玻尔兹曼在1877年的探讨比较接近。
对于“理想气体”(由基态的非相互作用原子所组成)的情况,所有能量都是动能的形式。宏观粒子的动能与动量的关系为:
其中 p 是动量矢量 p = [ p x , p y , p z ]的平方。因此,我们可以把方程1写成:
其中 Z 是配分函数,对应于方程1中的分母。在这里, m 是气体的分子质量, T 是热力学温度, k 是玻尔兹曼常数。这个 N i / N 的分布与找到具有这些动量分量值的分子的概率密度函数 f p 成正比,因此:
归一化常数 c 可以通过认识到分子具有 任何 动量的概率必须为1来决定。因此,方程4在所有 p x 、 p y 和 p z 上的积分必须是1。
可以证明:
把方程5代入方程4,得出:
可以看出,这个分布是三个独立、呈正态分布的变量 p x {\displaystyle p_{x}} 、 p y {\displaystyle p_{y}} 和 p z {\displaystyle p_{z}} 的乘积,其方差为 m k T {\displaystyle mkT} 。此外,可以看出动量的大小呈麦克斯韦-玻尔兹曼分布,其中 a = m k T {\displaystyle a={\sqrt {mkT}}} 。
能量的分布
利用 p ² = 2 mE ,以及动量的大小的分布函数(参见以下速率分布的章节),我们便得出能量的分布:
由于能量与三个呈正态分布的动量分量的平方和成正比,因此这个分布是具有三个自由度的卡方分布:
其中
麦克斯韦-玻尔兹曼分布还可以通过把气体视为量子气体来获得。
速度矢量的分布
认识到速度的概率密度函数 f v 与动量的概率密度函数成正比:
并利用 p = m v ,我们便得到:
这就是麦克斯韦-玻尔兹曼速度分布。在速度相空间( v x , v y , v z )的一块无穷小区域[ dv x , dv y , dv z ]内找到具有特定速度 v = [ v x , v y , v z ]的气体分子的几率为
像动量一样,这个分布是三个独立、呈正态分布的变量 v x {\displaystyle v_{x}} 、 v y {\displaystyle v_{y}} 和 v z {\displaystyle v_{z}} 的乘积,但方差为 k T m {\displaystyle {\frac {kT}{m}}} 。还可以看出,对于速度矢量[ v x , v y , v z ],麦克斯韦-玻尔兹曼速度分布是三个方向上的分布的乘积:
其中一个方向上的分布为:
这个分布具有正态分布的形式,其方差为 k T m {\displaystyle {\frac {kT}{m}}} 。正如所预料的,对于静止的气体,在任何方向上的平均速度都是零。
速率的分布

一些惰性气体在298.15 K(25 °C)的温度下的速率分布函数。y轴的单位为s/m,因此任何一段曲线下的面积(它表示速度处于那个范围的概率)都是无量纲的。
通常,我们更感兴趣于分子的速率,而不是它们的速度分量。麦克斯韦-玻尔兹曼速率分布为:
其中速率 v 定义为:
注意:在这个方程中,f(v)的单位是概率每速率,或仅仅是速率的倒数,如右图那样。
由于速率是三个独立、呈正态分布的速度分量的平方之和的平方根,因此这个分布是麦克斯韦-玻尔兹曼分布。
我们通常更感兴趣于粒子的平均速率,而不是它们的实际分布。平均速率、最概然速率(众数),以及均方根速率可以从麦克斯韦-玻尔兹曼分布的性质获得。
典型的速率
虽然以上的方程给出了速率的分布,或具有特定速率的分子的比例,我们通常更感兴趣于粒子的平均速率,而不是它们的实际分布。
最概然速率
最概然速率 v p ,是系统中任何分子最有可能具有的速率,对应于 f ( v )的最大值或众数。要把它求出来,我们计算 df / dv ,设它为零,然后对 v 求解:
得出:
其中 R 是气体常数, M =N A m 是物质的摩尔质量。
对于室温(300K)下的氮气(空气的主要成分),可得 v p = 422 {\displaystyle v_{p}=422} m/s。
平均速率
平均速率是速率分布的数学期望值:
均方根速率
均方根速率 v rms 是速率的平方的平均值的平方根:
三种典型速率的关系
它们具有以下的关系:
非统计的推导方式
马克斯威-玻尔兹曼速率分布也可直接由气体速率均向性以及分离变数的假设以微分方程计算得到指数函数之形式,微分方程解的未定数项则由粒子总数以及方均根速率和玻尔兹曼常量的气体动力论关系两者联立得解.详见外部链接.
相对论气体的速率分布
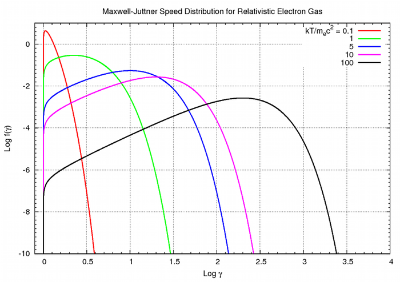
电子气体在不同温度下的Maxwell-Juttner速率分布 (相对论麦克斯韦分布)
当气体越来越热时, kT 趋于或超过 mc ,这个相对论麦克斯韦气体的速率分布由Maxwell-Juttner分布给出: :
其中 β β --> = v c , {\displaystyle \beta ={\frac {v}{c}},} γ γ --> = 1 1 − − --> β β --> 2 , {\displaystyle \gamma ={\frac {1}{\sqrt {1-{\beta ^{2}}}}},} θ θ --> = k T m c 2 , {\displaystyle \theta ={\frac {kT}{mc^{2}}},} 和 K 2 {\displaystyle K_{2}} 是第二类变形贝塞尔函数。
参见
玻尔兹曼因子
瑞利分布
理想气体状态方程
詹姆斯·克拉克·麦克斯韦
分子运动论
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

- 有价值
- 一般般
- 没价值








推荐阅读


关于我们

APP下载




















