



吲哚
历史
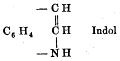
拜尔在1869年设想得吲哚的结构
吲哚化学是随着对靛青的研究开始发展的,继而转化为研究靛红,然后是羟吲哚。在1866年,阿道夫·冯·拜尔用锌粉将羟吲哚还原为了吲哚 。1869年,他假设出了吲哚的结构,至今仍然被大家公认 。
直到19世纪末,某些吲哚化合物也仅仅是作为重要的染料来看待。到了20世纪30年代,人们对吲哚的兴趣逐渐增强,因为吲哚作为一个核心基团出现在了很多重要的生物碱中,例如色氨酸和植物激素,到现在对于吲哚的研究仍然很活跃 。
自然的产生
吲哚是用苯甲酸被生物合成。
吲哚是煤焦油的主要成分,其中220-260℃的蒸馏产物是重要的工业原料。
吲哚的合成
吲哚及其衍生物可以被多种原料合成。主流的工业路线是以苯胺为原料,在催化剂存在下与乙二醇在气相反应得到 。
反应温度控制在200至500℃,产率可高达60% 。
合成吲哚的反应
Leimgruber-Batcho吲哚合成
Fischer吲哚合成
Bartoli吲哚合成
Bischler-Möhlau吲哚合成
Fukuyama吲哚合成
Gassman吲哚合成
Hemetsberger吲哚合成
Larock吲哚合成
Madelung合成
Nenitzescu吲哚合成
Reissert吲哚合成
Baeyer-Emmerling吲哚合成
吲哚的化学反应
碱性
不同于大多数胺,吲哚几乎没有碱性。它的成键环境与吡咯极为相似,只有像盐酸这样的强酸才可能将之质子化,得到的共轭酸的pKa是-3.6。很多吲哚类化合物(如色胺)在酸性环境下的活性都是由此产生的。
亲电取代反应
吲哚上最容易发生亲电取代反应的位置是3位,它的活性是其苯环碳的10 倍。例如Vilsmeier-Haack酰化反应在室温下就能于3位碳上发生 。由于吡咯环上电子富集,往往在1位氮和2,3位碳都被取代后,苯环上的亲电取代反应才可能发生。
芦竹碱是一种由吲哚、二甲亚胺和甲醛通过Mannich反应得到的常用中间体。它是3-吲哚乙酸和色氨酸的前体。
N位氢的酸性和金属有机盐
N位氢在DMSO中电离的pKa是21,所以需要非常强的碱,诸如氢化钠或者丁基锂,才有可能在无水环境下将之去质子化。得到的金属有机盐(具有非常强的碱性)有两种存在形式。对于难成共价键的钾、钠离子,负电荷集中在1位氮上;而对于可以成共价键的镁(包括Grignard试剂)和(尤其是)锌,负电荷则集中在3位碳上。类似的,在极性非质子溶剂比如DMF或DMSO中,1位氮易受到亲电试剂进攻;而在非极性溶剂比如甲苯中,则是3位碳更活泼 。
碳上氢的酸性和2位碳的锂化
2位碳上的氢酸性排第二。对于氮被保护了的吲哚衍生物,丁基锂或二异丙基氨基钾就专一地在2位碳上发生去质子反应,得到非常强的亲核试剂。 Bergman 和 Venemalm 开发出了在不保护氮的条件下在2位碳上取代的反应 。
Alan Katrizky 也曾开发出过类似的技术 。
吲哚的氧化
由于吲哚的富电子性,吲哚很容易被氧化。N-溴代丁二酰亚胺可以选择性的将吲哚氧化为羟吲哚 。
吲哚的环加成反应
只有2位碳和3位碳上的π键能发生环加成反应。吲哚发生分子间环加成的倾向不高,但其衍生物的分子异变却可以有很高的产率。例如 Padwa et al 通过Diels-Alder反应合成了士的宁的下一步中间体。在这个反应中,2-氨基呋喃作为了双烯体,而吲哚作为亲双烯体。
吲哚也可以发生分子内的 [2+3] 和 [2+2] 环加成反应。
相关化合物
苯
苯并呋喃
咔唑
咔啉
茚
吲哚啉
靛红
甲基吲哚
氧化吲哚
吡咯
粪臭素
吲哚乙酸
参见
异吲哚
Martinet合成
沼气
色胺
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

- 有价值
- 一般般
- 没价值








24小时热门
推荐阅读
关于我们

APP下载



















