



锕
历史
法国化学家安德烈-路易·德贝尔恩(André-Louis Debierne)在1899年宣布发现新元素。在玛莉·居礼和皮埃尔·居礼从沥青铀矿中分离出镭之后,德贝尔恩接着从残留物中再分离出这一新元素。他认为该元素与钛和钍相似,并将其命名为“actinium”。 德国化学家弗里德里希·奥斯卡·吉塞尔(Friedrich Oskar Giesel)则在1902年独立发现了锕元素。 他认为锕与镧相似,并在1904年将其命名为“emanium”。 科学家在比较德贝尔恩所得出的半衰期数据后, 决定依最早发现者的意愿把该元素正式定名为“actinium”。
锕的原文名称“actinium”源自古希腊语中的“ακτίς”、“ακτίνος”(“aktis”、“aktinos”),意为光线。 其化学符号为Ac,但Ac也同时是其他化学品的缩写,如乙酰基、乙酸盐 和乙醛,但锕与这些并无关系。
属性
锕是一种柔软的银白色 放射性金属。其剪切模量估计与铅相近。 锕的放射性很强,它放射出的高能粒子足以把四周的空气电解,因而发出暗蓝色光。 锕的化学属性与包括镧在内的镧系元素相近,因此要将锕从铀矿石中分离出来十分困难。分离过程一般使用溶剂萃取法和离子层析法。
锕是首个锕系元素。这些元素的特性比镧系元素更多元化,因此直到1945年,格伦·西奥多·西博格才提出为元素周期表加入锕系元素。这是自从德米特里·门捷列夫创造元素周期表以来对周期表最大的变动之一。
锕在空气中会与氧气、水汽迅速反应,在表面产生白色的保护性氧化层。 与大部分镧系和锕系元素一样,锕的氧化态通常是+3;Ac 离子在溶液中无色。 锕的电子排布是6d 7s ,所以当失去3个电子后,就会形成稳定的闭壳层,与稀有气体氡一样。 锕的+2态只出现在二氢化锕(AcH 2 )中。
化合物
已知的锕化合物非常少,其中有三氟化锕(AcF 3 )、三氯化锕(AcCl 3 )、三溴化锕(AcBr 3 )、氟氧化锕(AcOF)、氯氧化锕(AcOCl)、溴氧化锕(AcOBr)、三硫化二锕(Ac 2 S 3 )、氧化锕(Ac 2 O 3 )和磷酸锕(AcPO 4 )等。除AcPO 4 以外,这些化合物都具有+3氧化态,且都有相对应的镧化合物。 对应的镧和锕化合物在晶格常数上的差异不超过百分之十。
上表中的 a 、 b 和 c 为晶格常数, Z 为每晶胞所含的化学式单元数。密度并非实验数据,而是从晶体参数中计算得出的。
氧化物
在真空中把氢氧化锕加热至500°C或把草酸锕加热至1100°C,可制成氧化锕(Ac 2 O 3 )。氧化锕的晶体结构与大部分三价稀土金属的氧化物同型。
卤化物
三氟化锕的合成反应可以在液态或固态下进行。前者在室温下进行,需将氢氟酸加入含有锕离子的溶液中。后者需对锕金属施以氟化氢气体,反应要在700°C下进行,并必须使用全铂制器材。在900至1000°C下,三氟化锕会和氢氧化铵反应形成氟氧化锕(AcOF)。虽然三氟化镧在空气中以800°C燃烧一小时后就可以产生氟氧化镧,但是类似的方法无法产生氟氧化锕,而是会把三氟化锕熔解。
氢氧化锕或草酸锕与四氯化碳在960°C以上温度反应会产生三氯化锕。同样,三氯化锕与氢氧化铵在1000°C反应会形成氯氧化锕。但与氟氧化锕不同的是,三氯化锕在氢氯酸溶液中用氨点燃就可以产生氯氧化锕。
溴化铝与氧化锕反应后,会形成三溴化锕:
在500°C加入氢氧化铵,可以产生溴氧化锕(AcOBr)。
其他化合物
三氯化锕在300°C下经钾还原后,可形成氢化锕,其结构可从氢化镧(LaH 2 )的结构推测而得。该反应中氢的来源不明。
在含锕的氢氯酸溶液中加入磷酸二氢钠(NaH 2 PO 4 ),会产生白色的半水合磷酸锕(AcPO 4 ·0.5H 2 O)。草酸锕和硫化氢气体在1400°C受热几分钟,会产生黑色的硫化锕(Ac 2 S 3 )。
同位素
自然产生的锕元素由放射性同位素 Ac 组成。锕一共有36种已知同位素,全部都具有放射性。这些同位素的原子量介乎206u( Ac )和236 u( Ac )。 其中最稳定的有: Ac (半衰期为21.772年)、 Ac (10.0天)和 Ac (29.37小时)。其余的同位素的放射性半衰期都小于10小时,大部分甚至小于1分钟。寿命最短的锕同位素是 Ac ,其半衰期只有69纳秒,会进行α衰变和中子捕获。锕拥有两个亚稳态(同核异构体)。
纯化后的 Ac 在185天后与衰变产物达成平衡。它主要进行β衰变(98.8%),以及少量的α衰变(1.2%)。 这些衰变的产物都属于锕衰变系。 Ac 发射的β粒子能量较低(46keV),α辐射的强度较低,可用样本也一般很少,所以很难直接探测到 Ac 。因此科学家一般以探测其衰变产物的方法来推算 Ac 的量。
存量及合成

沥青铀矿中含有少量的锕元素。
锕元素在地球上十分稀少,只有痕量的 Ac同位素出现在铀矿石中:每吨铀矿石只含有大约0.2毫克的锕。 Ac是锕衰变系中的其中一个短暂存在的同位素。该衰变链始于235 U(或239 Pu),止于稳定同位素207 Pb。 Ac则是镎衰变系中短暂存在的同位素。该衰变链始于 Np(或 U),止于铊( Tl)和近似稳定的铋( Bi)。
含有锕的矿石中也同时含有镧及其他镧系元素。然而这些元素的化学、物理特性与锕非常接近,再加上锕含量更为稀少,因此从矿石中分离出锕元素的做法并不具实际性,科学家也从未完全分离出锕。 锕元素则通常是在核反应堆中用中子照射 Ra产生的,每次产量以毫克计。
该反应的锕产量约为镭重量的2%。 Ac可再捕获中子,形成少量的 Ac。合成过后,锕需从镭以及其他的衰变产物中分离出来,这些产物包括钍、钋、铅和铋。第一种分离法使用噻吩甲酰三氟丙酮和苯的混合溶液。调整该溶液的pH值,可从含衰变产物的溶液中萃取出特定的元素(锕需要pH 6.0左右)。 另一种分离法是在硝酸中以适当的树脂进行负离子交换法,先把镭和锕与钍分离开来(分离系数为1百万),再用正离子交换树脂和硝酸洗脱液把锕从镭中提取出来(系数为100)。
德国和澳洲的科学家在2000年首次人工合成 Ac。德国超铀元素研究所所使用的是回旋加速器,而澳洲的研究人员则使用位于悉尼圣乔治医院的直线加速器。 其合成方法为,对镭-226目标体进行20至30MeV能量氘离子撞击。这一反应同时会产生半衰期为29小时的 Ac同位素,但由于 Ac的半衰期有10天,所以前者不会对后者造成不纯。 Ac是一种稀有的同位素,在放射线疗法中有潜在的用途。
在1100至1300°C间以锂气体对氟化锕进行还原反应,可以产生锕金属。太高的温度会使产物气化,而太低温则会导致反应不能完全进行。锂的氟化物挥发性比其他碱金属的高,因此最适合用于这一反应中。
应用
由于存量稀少,价格昂贵,所以锕目前并无重要的工业用途。
Ac放射性很强,因此有潜力用于放射性同位素热电机中,应用范围包括航天器。 Ac的氧化物和铍压制后可以作为高效能中子源,其活度高于一般的镅﹣铍和镭﹣铍中子源。 这些应用利用的其实是 Ac的衰变产物。进行β衰变后所产生的同位素会释放α粒子,而铍则用于捕获这些α粒子,并放出中子。铍的(α,n)核反应截面较高,因此能高效地将α粒子转换为中子。该反应的公式如下:
AcBe可用于中子水分仪中,以测量土壤中的水分以及在建造公路时进行湿度、密度的质量检验。 这类探测仪在测井、中子照相、断层摄影术及其他放射性化学范畴中都有应用的空间。
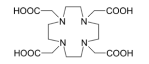
在放射线疗法中用于运输 Ac的DOTA载体的化学结构。
Ac在医学中用于制造 Bi, 或直接作放射线疗法的辐射源。 Ac的半衰期为10天,比 Bi的46小时更适合作放射线治疗。 Ac及其衰变产物所释放的α粒子可以杀死身体内的癌细胞。最大的困难在于,简单的锕配合物经静脉注射进入体内后,会积累在骨骼和肝脏中,并停留数十年。持续的辐射在杀死癌细胞后,会引发新的突变。要避免这种问题,可将 Ac与螯合剂结合,例如柠檬酸、乙二胺四乙酸(EDTA)和二乙烯三胺五乙酸(DTPA)。这可降低锕在骨骼中的积累,但从身体排泄的量仍然不高。改用HEHA 或耦合至曲妥珠单抗的DOTA(1,4,7,10-四氮杂环十二烷-1,4,7,10-四羧酸)等螯合剂可以增加锕的排泄量。曲妥珠单抗是一种单克隆抗体,能够干扰HER2/neu受体。科学家把锕与DOTA结合后注射到老鼠体内,发现疗法有效对抗白血病、淋巴瘤、乳癌、卵巢癌、神经母细胞瘤和前列腺癌。
Ac的半衰期为21.77年,可用来研究海水的缓慢垂直混合作用。这种水流的速度大约为每年50米,因此直接测量是无法得到足够的精度的。科学家通过探测各同位素在不同深度的相对比例变化,可以推算出混合作用的发生速率。具体的物理原理如下。海水含有均衡分布的 U。其衰变产物 Pa会慢慢沉淀到海底,所以其浓度会随深度增加,并在一定的深度以下维持恒等。 Pa再衰变成 Ac。混合作用会把海底的 Ac提升上来,因此 Ac的浓度随深度一直增加至海底。科学家分析 Pa和 Ac的浓度﹣深度关系,可以间接研究海水的混合作用。
安全
Ac的放射性超强,因此有关的实验都必须在专业实验室的手套箱中进行。当三氯化锕经静脉注射进入老鼠体内后,约33%的锕元素积累在骨骼中,50%进入肝脏。其毒性比镅和钚稍低。
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

相关资料

- 有价值
- 一般般
- 没价值








24小时热门
推荐阅读
关于我们

APP下载



















