



吉布斯能
概述

反应C(s, 金刚石)⇒C(s, 石墨)的吉布斯能变化量在25℃和1大气压下为负值,所以是热力学自发的。然而,这个反应的速率小到可以忽略不计。由此可见,反应的自发性并不能决定其速率
从热力学第二定律,可以推论,在标准状况下(或更一般地,等温等压的状况下),系统的变换通常会自然地趋向于最小吉布斯能。
在等温等压的状况下,一个反应所产生的吉布斯能变化量Δ Δ -->G{\displaystyle \Delta G}量度这反应的自发性。这反应发生的必要条件是,这反应的吉布斯能变化量小于或等于其所获得的非体积功W′{\displaystyle W"}:
这意味着,当这反应做出非体积功时,吉布斯能变化量Δ Δ -->G{\displaystyle \Delta G}是负值,即吉布斯能会减少。假若这反应是可逆的,则吉布斯能减少量等于所做出的非体积功:
假设这反应的吉布斯能变化量Δ Δ -->G{\displaystyle \Delta G}是正值(这意味着吉布斯能的增加),则必须注入能量来促使反应发生,这能量的形式可以是电功或其它种非体积功。
从整个孤立系统的角度来分析吉布斯能的物理机制。孤立系统是由反应与环境所组成。对于这反应过程,整个孤立系统的熵变化量等于反应与环境的熵变化量的总和,其大于或等于零;否则,此过程不可行;假若过程为可逆过程,则总和为零。在等温等压状况下,这结果意味着吉布斯能变化量为负值,这种反应称为放能反应(英语:exergonic)。
假设将几个反应耦合在一起,则一个不具自发性的吸能反应(英语:endergonic)(吉布斯能变化量为正值),可以改为具有自发性。将热能注入一个吸能反应,可以被视为将不具自发性反应与自发性反应耦合在一起,这样,整体的总熵变化量会大于或等于零,从而促使耦合反应的总吉布斯能变化量成为负值。
按照惯例,在术语“吉布斯自由能”里的“自由”两个字的意思是“以有用功的形式被释出”更精确地说,“自由能”的意思是以非体积功的形式被释出的能量。(对于等温系统,“自由”这词的意思,虽然稍微不同,也可以类比地适用于亥姆霍兹自由能,更精确地说,它是以功的形式被释出的能量)当今,越来越多书籍与期刊论文会忽略使用“自由”这词,改简称为“吉布斯能”。这是国际化会在1988年大会为了统一国际科学术语而达成的共识。然则,这术语标准至今尚未被普遍地遵循采纳。
自发过程与平衡过程
设想一个完全不与外界交换能量或质量的孤立系统,其熵为Stot{\displaystyle S_{\mathrm {tot} }}。根据热力学第二定律,孤立系统会自发地朝着最大熵状态演化,即孤立系统的熵变化量Δ Δ -->Stot{\displaystyle \Delta S_{\mathrm {tot} }}大于或等于零:
假若Δ Δ -->Stot=0{\displaystyle \Delta S_{\mathrm {tot} }=0},则此过程是可逆过程。
假设这孤立系统是由一个子系统与环境组成,孤立系统的内部是处于等温等压状况,子系统可以与环境交换热能与功。子系统在这里简称为“系统”。S{\displaystyle S}、Ssurr{\displaystyle S_{\mathrm {surr} }}分别为系统与环境的熵,它们的熵变化量的总和满足以下关系式:
假若系统从环境中吸取热能Q{\displaystyle Q},则按照熵的定义,
所以,
从吉布斯能的定义式,可以得到其变化量为
焓的定义式为
焓变化量为
非体积功是零的状况
假设非体积功为零,则内能变化量为
总和吉布斯能变化量、焓变化量与内能变化量,可以得到
因此,在等温等压与非体积功为零的状况前提下,吉布斯能变化量必定小于或等于零:
换句话说,在等温等压与非体积功为零的状况下,仅需考虑系统的吉布斯能变化量,就可以评估热力学过程是否为自发进行,而不必考虑外在环境因素。吉布斯能变化量可能属于以下三种值域:
Δ Δ -->G<0{\displaystyle \Delta G<0}:过程具有自发性。
Δ Δ -->G=0{\displaystyle \Delta G=0}:过程处于平衡状态。
Δ Δ -->G>0{\displaystyle \Delta G>0}:过程被严格禁止。
注意到在等温等压与非体积功为零的状况下,系统的吉布斯能变化量与孤立系统的熵变化量,两者之间的关系为
这意味着,孤立系统的熵的增加对应着子系统的吉布斯能的减少,所以,热力学的自发方向是朝着吉布斯能的减少方向,吉布斯能可以评估一个热力学过程的自发性。由于化学实验通常是在等温等压状况下进行,所以,吉布斯能是一种极具功能的热力学概念。
非体积功不是零的状况
假设在等温等压状况下,系统从环境获得非体积功W′{\displaystyle W"},则内能变化量为
系统的吉布斯能变化量为
吉布斯能变化量Δ Δ -->G{\displaystyle \Delta G}与系统所获得非体积功W′{\displaystyle W"},两者的关系为:
换句话说,系统的吉布斯能减少量− − -->Δ Δ -->G{\displaystyle -\Delta G}与系统对于环境所做的非体积功− − -->W′{\displaystyle -W"},两者的关系为
系统所做的非体积功不是状态函数,其数值是依工作路径而定,而吉布斯能是状态函数,吉布斯能减少量与工作路径无关,所以,在等温等压状况下,系统的吉布斯能减少量是其所能做的最大非体积功。
化学反应
化学反应也是一种热力学过程,所以前面的分析也适用于化学反应。在等温等压状况下,吉布斯能减少量可以用来评估化学反应的自发性,而当吉布斯能变化量等于零时,化学反应处于平衡状态。
标准生成吉布斯能
由于热力学不能定义吉布斯能的绝对数值,所以实际应用时,可以利用它是状态函数的性质来计算物质的标准生成吉布斯能(英语:standard Gibbs free energy of formation),全名为“标准摩尔生成吉布斯能”,标记为“Δ Δ -->fGm⊖ ⊖ -->{\displaystyle \Delta _{\mathrm {f} }G_{\mathrm {m} }^{\ominus }}”或“Δ Δ -->fG⊖ ⊖ -->{\displaystyle \Delta _{\mathrm {f} }G^{\ominus }}”。首先,需要设定参考状态的标准生成自由能为零;在标准状况下,所有最稳定形式的元素都被指定为处化合物状态。下一步,对于化合物或其它形式的元素,它们的标准生成吉布斯能被设定为,从最稳定形式的元素生成一摩尔化合物或其它形式的元素,所需要的吉布斯能变化量。在实验方面,有很多方法可以用来估算物质的标准生成吉布斯能,例如,可以从物质的焓变化量与熵变化量实验数据,利用吉布斯能的定义式估算出来。平常运算则可以从焓与熵列表里查询相关数值。
假若某物质的标准生成吉布斯能是负值,则称该物质为“热力学稳定物质”;假若是正值,则为“热力学不稳定物质”。例如,水的标准生成吉布斯能是负值,所以在标准状况下很稳定。又例如,苯的标准生成吉布斯能是正值,所以在标准状况下不稳定。
标准反应吉布斯能
通过标准生成吉布斯能,可以估算化学反应所需的“标准反应自由能”。在标准状况下,反应物变化为产物所需的吉布斯能变化量,就是标准反应吉布斯能,常用符号Δ Δ -->rGm⊖ ⊖ -->{\displaystyle \Delta _{\mathrm {r} }G_{\mathrm {m} }^{\ominus }}或“Δ Δ -->rG⊖ ⊖ -->{\displaystyle \Delta _{\mathrm {r} }G^{\ominus }}”表示。对于一般反应
标准反应吉布斯能为
一般化学教科书和化学手册中都会列出常见物质的标准生成吉布斯能(同时还会列出生成焓和标准熵),直接查表便可估算化学反应所需的标准反应自由能。
假若Δ Δ -->rG⊖ ⊖ -->{\displaystyle \Delta _{\mathrm {r} }G^{\ominus }}为负值,则反应会自发进行;否则,假若为正值,则逆反应会自发进行。通常而言,Δ Δ -->rG⊖ ⊖ -->{\displaystyle \Delta _{\mathrm {r} }G^{\ominus }}不等于零,因为不涉及化学平衡论题。
开放系统
开放系统是一种能够与其环境传递能量和物质的热力学系统。在开放系统里,内能与每一种物质组分的数量有关:
其中,ni{\displaystyle n_{i}}是物质组分 i{\displaystyle i} 的摩尔数。
内能的全微分是
其中,μ μ -->i=(∂ ∂ -->U∂ ∂ -->ni)S,V,nj≠ ≠ -->i{\displaystyle \mu _{i}=\left({\frac {\partial U}{\partial n_{i}}}\right)_{S,V,n_{j\neq i}}}是物质组分i{\displaystyle i}的化学势。
从吉布斯能的定义式,可以得到吉布斯能的全微分:
所以,化学势与吉布斯能的关系为
在等温等压状况下,吉布斯能的全微分是
吉布斯能是个状态函数,当做积分运算时,吉布斯能的数值与积分路径无关。由于化学势只与温度、压强、物质组分比率有关,假若增加物质的总数量,而维持物质组分比率不变,则吉布斯能的微分式可以表示为
其中,dx=dni/ni{\displaystyle \mathrm {d} x=\mathrm {d} n_{i}/n_{i}}是每一种物质组分同步增加的分率。
这样,可以做积分得到吉布斯能:
理想气体混合物
假设在系统里,只有一种理想气体组分,则从吉布斯能的全微分,可以得到偏导数
其中,Gm{\displaystyle G_{m}}是摩尔吉布斯能,Vm{\displaystyle V_{m}}是摩尔体积。
对这偏微分方程做积分,可以得到
其中,Gm0{\displaystyle G_{m0}}是在参考压强p0{\displaystyle p_{0}}的摩尔吉布斯能,其只与温度有关。
为了简便起见,设定参考压强为1atm,在计算时,压强p{\displaystyle p}的单位必须为atm。这样,可以将方程表示为
假设系统有多种理想气体组分,由于假定分子尺寸很微小,并且分子与分子之间不相互作用,则根据道尔顿分压定律,理想气体的压强与分压之间的关系为
其中,pi{\displaystyle p_{i}}是第 i{\displaystyle i} 种理想气体的分压。
因此,第 i{\displaystyle i} 种理想气体的吉布斯能为
按照比例,第 i{\displaystyle i} 种理想气体的化学势为
对于气体反应
吉布斯能变化量为
其中,Δ Δ -->G0{\displaystyle \Delta G_{0}}是标准反应吉布斯能,Q=pcc pddpaa pbb{\displaystyle Q={\frac {p_{c}^{c}\ p_{d}^{d}}{p_{a}^{a}\ p_{b}^{b}}}}是反应商。
假若吉布斯能变化量为负值,则反应会自发进行;否则,假若为负值,则逆反应会自发进行。换句话说,整个反应朝着吉布斯能减少的方向进行。
假设反应达成化学平衡,则吉布斯能变化量为零:
平衡常数K{\displaystyle K}定义为
所以,平衡常数与温度有关:
这样,可以给出以下结论:
Δ Δ -->G0>0{\displaystyle \Delta G_{0}>0} 时,K<1{\displaystyle K<1}。
Δ Δ -->G0=0{\displaystyle \Delta G_{0}=0} 时,K=1{\displaystyle K=1}。
Δ Δ -->G0<0{\displaystyle \Delta G_{0}1{\displaystyle K>1}。
电化学
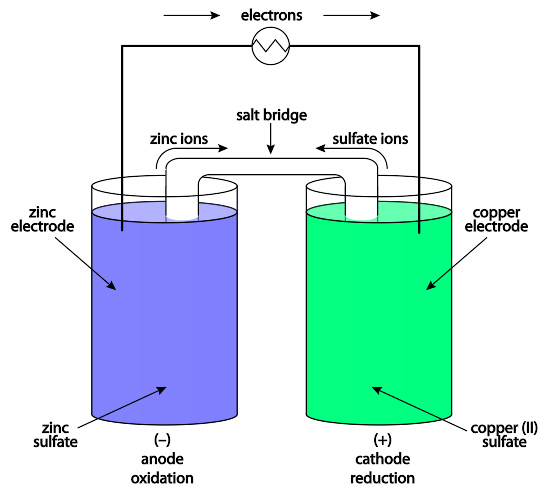
锌铜电池是一种伽凡尼电池。由铜构成的正极沈浸于CuSO4溶液内,由锌构成的负极沈浸于ZnSO4溶液内。在两杯溶液间连接着一座KCl盐桥。由于电动势的驱使,电子会从负极移动经过外电路抵达正极。产生这电动势的化学反应为Zn(s) + Cu(aq) → Zn(aq) + Cu(s)
前面非体积功不是零的状况段落阐明,在等温等压状况下,系统的吉布斯能减少量是其所能做的最大非体积功:
在电化学里,电化电池所做的非体积功− − -->W′{\displaystyle -W"}就是电功,其最大值就是电池反应的吉布斯能减少量。假设,有n{\displaystyle n}摩尔电子从电池的负极移动经过外电路抵达电池的正极,而电池的电动势为E{\displaystyle {\mathcal {E}}},则所获得的非体积功为
其中,F{\displaystyle {\mathcal {F}}}为法拉第常数,即一摩尔电子所带有的电荷。
假设整个过程为可逆过程,则可得到电化学的基础方程,其表示出吉布斯能变化量与电动势的关系:
所以,电动势为
对于所有反应物与产物都处于标准状况的案例,电池的电动势称为“标准电动势”,标记为E⊖ ⊖ -->{\displaystyle {\mathcal {E}}^{\ominus }},以方程定义为
化学反应会朝着吉布斯能减少的方向自发进行。换句话说,朝着这方向,化学反应的吉布斯能变化量为负值。这意味着电动势为正值,电池为原电池,无须置入外电压源,电子就会通过外电路从负极移动至正极。
假若电动势为负值,则电池为电解池,需要置入外电压源,电子才能按照反应式的正方向移动。
将处于化学平衡的化学反应的Δ Δ -->G{\displaystyle \Delta G}公式代入电动势公式,可以得到
再将标准电动势的定义式代入,则可得到能斯特方程:
通过此式,可以估算出,在任意状况下,电动势的数值。
历史
早期,化学家使用术语“亲和势(英语:chemical affinity)”来描述促成化学反应的因素,但这术语已过时,现今已被术语“自由能”替代,自由能是一种比较先进与准确的术语。
1873年,吉布斯发表论文《用曲面方法来几何表现出物质的热力学性质》。在这篇论文里,他详细论述他的新方程的原理。这方程可以预测或估算,当几样物体或系统接触在一起之时,各种自然过程发生的趋势。通过研究几样均一性物质接触时的相互作用,例如,由一部分固体、一部分液体与一部分气体构成的物体,又通过展示相关体积-熵-内能三维图,吉布斯可以判断三种平衡状态,即稳定平衡、中性平衡或不稳定平衡,以及是否会发生后续变化。吉布斯阐明,
在这论述里,ε、η、ν分别是物体的内能、熵与体积。
在这之后,于1882年,德国物理学者赫尔曼·冯·亥姆霍兹描绘亲和势为能够从可逆性反应获得的最大功,例如,从可逆性电池获得的电功。按照这观点,最大功被视为系统的自由能减少量(在等温等压状况下的吉布斯能, 或在等温等容状况下的亥姆霍兹能),而释出的热能通常是系统的总能量减少量。这样,吉布斯能或亥姆霍兹能是,在给定状况下,可提供为功的能量。
在那个时间岭之前,一般观点为,"所有化学反应会驱使系统至反应亲和势消失殆尽的平衡状态"。之后60年,术语“亲和势”渐渐被术语“自由能”替代。根据化学历史学者亨利·赖瑟斯特(英语:Henry Leicester)的纪载,于1923年,吉尔伯特·路易斯与莫尔·冉道尔(英语:Merle Randall)发表了一本很具影响力的教科书《热力学与化学物质的自由能(英语:Thermodynamics and the Free Energy of Chemical Substances)》,在大部分英语系世界的国家,这本书籍促成了人们青睐与使用术语“自由能”。
参阅
化学势
亥姆霍兹自由能
自由能
吉布斯—亥姆霍兹方程
注释
^1.01.1热力系统在压强的作用下因体积变化所做的功是体积功;任何其它种类的功属非体积功,例如,由于弹簧伸展而做的弹性功,由于电池内化学变化生成的电功,由于肌肉运动而产生的生物功等等,都是非体积功。
^电动势E{\displaystyle {\mathcal {E}}}以方程定义为E =def Φ Φ -->cathode− − -->Φ Φ -->anode{\displaystyle {\mathcal {E}}\ {\stackrel {def}{=}}\ \Phi _{cathode}-\Phi _{anode}};其中,Φ Φ -->cathode{\displaystyle \Phi _{cathode}}与Φ Φ -->anode{\displaystyle \Phi _{anode}}分别为电池正极与负极的电势。
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

- 有价值
- 一般般
- 没价值








推荐阅读
关于我们

APP下载



















