



野依不对称氢化反应
参见化学反应列表科里–巴克什–柴田还原反应参考资料^Noyori,R.,Okhuma,T.;Kitamura,M.;Takaya,H.;Sayo,N.;Kumobayashi,H.;Akuragawa,S.J.Am.Chem.Soc.1987,109,5856–5858.(doi:10.1021/ja00253a051)^Kitamura,M.;Tokunaga,M.;Ohkuma,T.;Noyori,R.Org.Syn.,Coll.Vol.9,p.589(1998);Vol.71,p.1(1993).(Article)^Takaya,H.;Akutagawa,S.;Noyori,R.Org.Syn.,Coll.Vol.8,p.57(1993);Vol.67,p.20(1989).(Article)^Noyori,Ryoji.AsymmetricCatalysisInOrganicSynt...
参见
化学反应列表
科里–巴克什–柴田还原反应
参考资料
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。
——— 没有了 ———
编辑:阿族小谱

文章价值打分
- 有价值
- 一般般
- 没价值
当前文章打 0 分,共有 0 人打分
文章观点支持

0

0
文章很值,打赏犒劳一下作者~

发表评论
写好了,提交
{{item.label}}
{{commentTotal}}条评论
{{item.userName}}
发布时间:{{item.time}}
{{item.content}}
回复
举报


打赏作者
“感谢您的打赏,我会更努力的创作”
— 请选择您要打赏的金额 —
{{item.label}}


{{item.label}}

打赏成功!
“感谢您的打赏,我会更努力的创作”
返回
打赏
私信
推荐阅读
· 野崎–桧山–岸反应
历史该反应系高井和彦、野崎一(HitosiNozaki)和桧山为次郎(TamejiroHiyama)在1977年报道,其最早发现的为铬(Ⅱ)催化的苯甲醛与烯丙基氯间的偶联,其中铬(Ⅱ)盐由氯化铬(Ⅲ)与氢化铝锂作用制得。1983年反应适用范围被拓展至以乙烯基卤、三氟甲磺酸酯和芳基碘化物或溴化物作为底物。研究发现反应效果与氯化铬(Ⅱ)的来源有很大关系。1986年,高井和彦等人发现了氯化铬(Ⅱ)中的镍杂质对碳铬键形成有明显的促进作用,从而发现镍对反应的共催化作用。同年,岸义人(YoshitoKishi)等在合成沙海葵毒素(palytoxin)时,也分别发现镍的催化作用。反应特点反应条件温和,可在酮存在下选择性地与醛反应,而酰胺基、酯基、氰基等基团均不受影响。巴豆基型铬试剂具有高度的立体选择性,无论E型还是Z型试剂均形成anti产物。适当溶剂中,当醛上含较大基团时,可得相反的立体选择性。二取代烯...
· 夏普莱斯不对称双羟基化反应
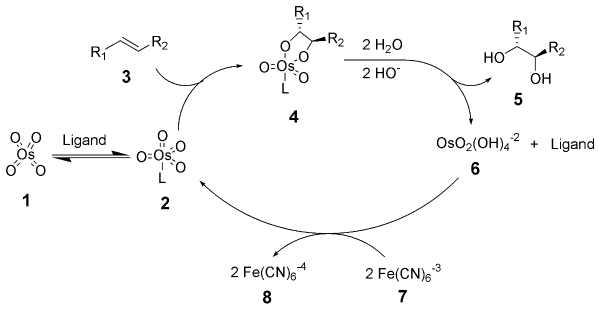
反应机理反应的催化循环如下。由锇酸钾原位生成的四氧化锇与配体结合为络合物2,该络合物对烯烃发生对映选择性的[3+2]环加成反应(锇氧化反应)。生成的锇酸酯4经水解得到二醇和被还原的锇酸盐。后者被计量的再氧化剂氧化为四氧化锇而重复使用。实例1、氮杂糖6合成中的1至2一步:2、IsaoKuwajima的紫杉醇全合成中也用到了一个夏普莱斯不对称双羟化反应。参见不对称催化氧化反应Milas羟基化反应Upjohn双羟基化反应Sharpless不对称氨羟基化反应化学反应列表
· 夏普莱斯不对称环氧化反应
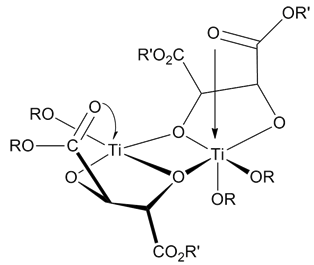
催化剂结构催化剂的结构直到现在还未非常确定。还未有研究能够完全排除其他假定的催化剂。无论如何,所有的研究都表明催化剂是一种[Ti(tartrate)(OR)2]的二聚体。催化剂模型通过X-射线鉴定了结构。过渡态机理该反应是以四价钛酸酯路易斯酸介导,以过氧化氢衍生物为氧化剂(常为叔丁基过氧化氢),以酒石酸乙酯为立体诱导配体而进行的烯烃环氧化反应。夏普莱斯不对称环氧化反应机理反应选择性夏普莱斯环氧化反应的产物可以通过下列的模型进行预测:确定一个双键平面,并在双键平面上画出一个与之围绕的矩形。朝着右下角画出烯丙醇羟基,然后按照分子结构在其他矩形角上画出其他取代基。在氧化方向上,(-)酒石酸乙酯优先从上方和双键反应,而(+)酒石酸乙酯优先从下方与分子进行反应。这种模型对于大多数的烯烃化合物都有效。而当R1基团较大时选择性会降低,当R2和R3基团较大时选择性会提高。夏普莱斯环氧化选择性夏普莱斯环氧化...
· 氢化物
分类氢化物基本上可按以下标准分类:氢负离子氢负离子H,由两个电子及一个质子组成,是已知除电子盐外最小的阴离子。氢负离子不能在水溶液中存在,是已知的最强碱之一,这可通过以下生成反应看出:负氢是非常强的还原剂:已知自由氢负离子的有效半径为208pm。这个数据与其他数据比较时,特别是与He原子的93pm,H原子的50pm,Cl的结晶半径181pm,H的共价半径30pm,及类盐氢化物中H的半径(134-154pm)相比是有趣的。这个反常大的半径可以用H的核电荷较小,电子彼此排斥和对核引力的屏蔽效应来解释。离子型氢化物由于H离子的生成热为正值,因此只有电正性大的元素才能与氢形成离子型氢化物。这类化合物在熔融电解时阳极产生氢气,可证明其离子性。这类化合物中H的结晶半径介于F−和Cl−之间,因此某种氢化物的晶格能与相应的氟化物及氯化物相近。但是氢化物的生成热相对于卤化物却非常低,例如碱金属卤化物的生成热...
· 硼氢化钠
发现硼氢化钠是由H.C.Brown和他的导师Schlesinger于1942年在芝加哥大学发现的。当时的目的是为了研究硼烷和一氧化碳络合物的性质,但却发现了硼烷对有机羰基化合物的还原能力。由于当时硼烷属于稀有物质,因此并没有引起有机化学家的重视。硼烷化学的发展得益于第二次世界大战,当时美国国防部需要寻找一种分子量尽量小的挥发性铀化合物用于裂变材料铀235的富集。硼氢化铀U(BH4)4符合这个要求。该化合物的合成需要用到氢化锂,然而氢化锂的供应很少,于是便宜的氢化钠便被用来作原料,而硼氢化钠就在这个过程中被发现。后来,因为六氟化铀的处理工艺问题得到解决,国防部便放弃了通过硼氢化铀来富集铀235的计划,而Brown的研究课题就变成了如何方便地制备硼氢化钠。ArmySignalCorps公司对这个新化合物的野外就地制备大量氢气的用途产生了兴趣。在他们的资助下,开展了相关的工业化研究,产生了后来工...
关于我们

关注族谱网 微信公众号,每日及时查看相关推荐,订阅互动等。
APP下载

下载族谱APP 微信公众号,每日及时查看

扫一扫添加客服微信















